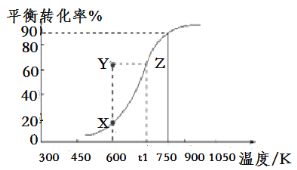
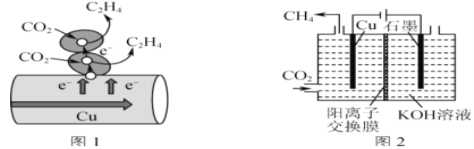
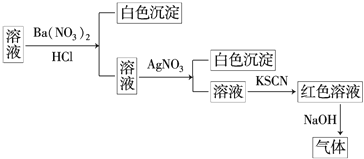
题目内容
【题目】室温下,在pH=12的某溶液中,分别有甲、乙、丙、丁四位同学计算出由水电离出的c(OH-)的数据分别为甲:1.0×10-7 mol·L-1;乙:1.0×10-6 mol·L-1;丙:1.0×10-2 mol·L-1;丁:1.0×10-12 mol·L-1。其中你认为可能正确的数据是( )
A.甲、乙B.乙、丙C.丙、丁D.乙、丁
【答案】C
【解析】
pH=12,说明溶液显碱性,则溶液可能为碱溶液,也有可能是强碱弱酸盐溶液,以此根据水的离子积常数进行计算。
pH=12,说明溶液显碱性,则该溶液可能为碱溶液,也有可能是强碱弱酸盐溶液;
1.若是碱溶液,c(H+)=1.0×10-12mol/L,碱溶液中氢离子来源于水的电离,由水电离出的氢离子与氢氧根离子相等,故由水电离出的c(OH-)=1.0×10-12mol/L,则丙正确;
2.若是强碱弱酸盐溶液,c(H+)=1.0×10-12mol/L,c(OH-)=![]() =1.0×10-2mol/L,强碱弱酸盐溶液中氢氧根离子来源于水的电离,故由水电离出的c(OH-)=1.0×10-2mol/L,则丁正确;
=1.0×10-2mol/L,强碱弱酸盐溶液中氢氧根离子来源于水的电离,故由水电离出的c(OH-)=1.0×10-2mol/L,则丁正确;
故可能正确的数据是丙、丁;故合理选项是C。

练习册系列答案
 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目