题目内容
【题目】无水AlCl3可用作有机合成的催化剂,食品膨松剂等。已知AlCl3、FeCl3分别在183℃、315℃时升华,无水AlCl3遇潮湿空气即产生大量白雾。
I.工业上由铝土矿(主要成分是Al2O3和Fe2O3)和石油焦(主要成分是碳单质)制备无水AlCl3的流程如下:
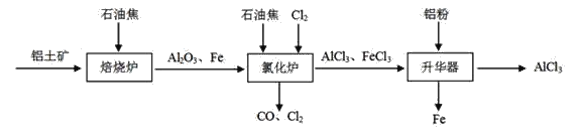
(1)焙烧炉中发生反应:①Fe2O3(s)+3C(s)![]() 2Fe(s) +3CO(g);
2Fe(s) +3CO(g);
②3CO(g)+Fe2O3(s)![]() 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
则反应②的平衡常数的表达式为K=_____。
(2)氯化炉中Al2O3、Cl2和C在高温下发生反应的化学方程式为_____;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为____。
(3)精制无水AlCl3的合格品中,AlCl3的质量分数不得低于96%。现称取16.25g精制后的无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,其残留固体质量为0.16g。该样品中AlCl3的质量分数为_____。
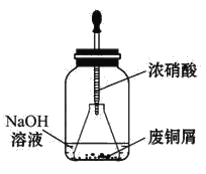
II.实验室可用下列装置制备无水AlCl3。装置B、C中应盛放的试剂名称分别为_____、_____,F中所盛放试剂的作用是_____。
【答案】K=![]() Al2O3+3Cl2+3C
Al2O3+3Cl2+3C![]() 2AlCl3+3CO SO32-+Cl2+2OH-=SO42-+2Cl-+H2O 98% 饱和食盐水 浓硫酸 防止水蒸气进入E装置
2AlCl3+3CO SO32-+Cl2+2OH-=SO42-+2Cl-+H2O 98% 饱和食盐水 浓硫酸 防止水蒸气进入E装置
【解析】
I.(1)根据反应②的方程式3CO(g)+Fe2O3(s)![]() 2Fe(s)+3CO2(g),由于Fe2O3、Fe的状态都是固体,平衡常数的表达式为K=c3(CO2)/c3(CO),故答案为:K=
2Fe(s)+3CO2(g),由于Fe2O3、Fe的状态都是固体,平衡常数的表达式为K=c3(CO2)/c3(CO),故答案为:K=![]() ;
;
(2)观察流程中氯化炉装置的物质进入和出去(看箭头指示),可以推出反应物是Fe、Al2O3、Cl2和C,生成物是AlCl3、FeCl3和CO,由此可得Al2O3、Cl2和C在高温下发生反应的产物是AlCl3和CO,反应的化学方程式为Al2O3+3Cl2+3C![]() 2AlCl3+3CO;Na2SO3溶液除去Cl2的原理是SO32-的还原性强将Cl2还原成Cl-,自身被氧化成SO42-,因SO32-水解溶液呈碱性,离子方程式为SO32-+Cl2+2OH-=SO42-+2Cl-+H2O;
2AlCl3+3CO;Na2SO3溶液除去Cl2的原理是SO32-的还原性强将Cl2还原成Cl-,自身被氧化成SO42-,因SO32-水解溶液呈碱性,离子方程式为SO32-+Cl2+2OH-=SO42-+2Cl-+H2O;
(3)AlCl3样品溶于过量的NaOH溶液后,Al元素全部转化为AlO2-进入溶液,因此过滤后的残留固体质量0.16g是样品中的杂质,AlCl3的质量分数=(16.25g-0.16g)÷16.25g=98%,故答案为:98%;
II.制备无水AlCl3,结合无水AlCl3遇潮湿空气会产生大量白雾的信息,应先制得纯净而干燥的氯气与Al反应,还要防止外界空气中的水蒸气进入装置而使AlCl3水解,由此可得装置B的作用是除去Cl2中混有的HCl,盛放饱和食盐水,装置C的作用是除去Cl2中混有的H2O,盛放浓硫酸,F中所盛放试剂的作用是防止水蒸气进入E装置而使AlCl3水解;故答案为:饱和食盐水;浓硫酸;防止水蒸气进入E装置。

 名校课堂系列答案
名校课堂系列答案【题目】以石墨为电极分别电解水和饱和食盐水,关于两个电解池反应的说法正确的是( )
A.阳极反应式相同
B.电解结束后所得液体的pH相同
C.阴极反应式相同
D.通过相同电量时生成的气体总体积相等(同温同压)
【题目】已知:![]()
![]() 。在
。在![]() 的密闭容器中进行模拟合成实验,将
的密闭容器中进行模拟合成实验,将![]() 和
和![]() 通入容器中,分别在
通入容器中,分别在![]() 和
和![]() 反应,每隔一段时间测得容器中的甲醇的浓度如下:
反应,每隔一段时间测得容器中的甲醇的浓度如下:
| 10 | 20 | 30 | 40 | 50 | 60 |
300 | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
500 | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
下列说法正确的是 ![]()
![]()
A.![]() 时,开始
时,开始![]() 内
内![]() 的平均反应速率
的平均反应速率![]()
B.反应达到平衡时,两温度下CO和![]() 的转化率之比均为
的转化率之比均为![]()
C.![]() 反应达到平衡时,放出的热量为
反应达到平衡时,放出的热量为![]()
D.![]() 时,若容器的容积压缩到原来的
时,若容器的容积压缩到原来的![]() ,则
,则![]() 增大,
增大,![]() 减小
减小