题目内容
【题目】下列有关叙述不正确的是
A.冰醋酸中逐滴加水,则溶液的导电性和醋酸的电离程度均先增大后减小
B.若根据反应“![]() ”设计成燃料电池,既可发电同时还可用于制备盐酸
”设计成燃料电池,既可发电同时还可用于制备盐酸
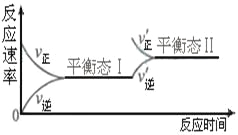
C.可逆反应的正、逆反应平衡常数数值互为倒数
D.电镀铜时,纯铜做阳极,电镀液为![]() 溶液
溶液
【答案】A
【解析】
A.弱电解质加水稀释后电离度增大,但加水稀释时离子浓度不一定增大,当加水稀释到一定程度之后,电离的程度小于溶液体积增大的程度时溶液的离子浓度反而减小,故A错误;
B.反应“![]() ”设计成燃料电池,负极上通入氢气,正极上通入氯气,反应产物为HCl,既可发电同时还可用于工业制盐酸,故B正确;
”设计成燃料电池,负极上通入氢气,正极上通入氯气,反应产物为HCl,既可发电同时还可用于工业制盐酸,故B正确;
C.温度一定时,对于给定的化学反应,正反应的反应物和生成物分别为逆反应的生成物和反应物,所以正逆反应的平衡常数互为倒数,故C正确;
D. 电镀铜时,阴极上阳离子得电子析出铜单质,纯铜做阳极,电镀液为![]() 溶液,故D正确.
溶液,故D正确.
故选:A。

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是
A | B | C | D | |
图示 |
|
|
|
|
相关 信息 | 温度计的水银柱不断上升 | 反应物总能量大于生成物总能量 | 反应开始后,甲处液面低于乙处液面 | 反应开始后,针筒活塞向右移动 |
A.AB.BC.CD.D