题目内容
【题目】现有部分元素的性质与原子(或分子)结构如图:
元素符号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第3周期元素的简单离子中半径最小 |
(1)画出元素T的原子结构示意图___________。
(2)元素Y与元素Z相比,金属性较强的是_________(用元素符号表示),下列表述中
能证明这一事实的是_________(填序号)。
A、Y单质的熔点比Z单质低 B、Y的化合价比Z低
C、Y单质与水反应比Z单质剧烈 D、Y的最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性键的化合物,写出该化合物的化学式____________。
(4)元素T和氢元素以原子个数比1:1化合物形成的化合物的电子式______________。
【答案】 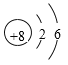 Na CD Na2O2
Na CD Na2O2 ![]()
【解析】T:最外层电子数是次外层电子数的3倍,最外层电子数不超过8个,所以,次外层是K层,最外层是L层,K层排2个电子,L层排6个电子,所以是氧元素;X:由常温下单质为双原子分子,分子中含有3对共用电子对知,该元素原子最外层5个电子,主族元素的族序数=其最外层电子数,所以是氮元素;Y:由M层比K层少1个电子知,其核外电子排布是:2、8、1,所以是钠元素;Z:第3周期元素的简单离子中半径最小,由元素周期律知,金属阳离子,随原子序数的增大离子半径减小,阴离子得电子后比金属阳离子多一个电子层,都比金属离子半径大,所以是Al元素;
(1)T为氧元素,核外电子排布是2、6,原子结构示意图为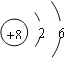 ;
;
(2)YZ分别是钠铝元素,根据元素周期律知,金属性较强的是Na,比较金属强弱的方法有:与水或酸反应的剧烈程度,其最高价氧化物的水化物的碱性强弱,金属活动性顺序表等,所以选C、D;
(3)上述元素中,由其中两种元素形成的既有离子键又有非极性共价键的物质常见的是Na2O2;
(4)氧元素与氢元素形成的原子个数比为1:1的化合物Q是H2O2.其电子式为![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案