题目内容
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)为原料,制备粗铅,可以实现铅的再生利用。其工艺流程如图1所示:
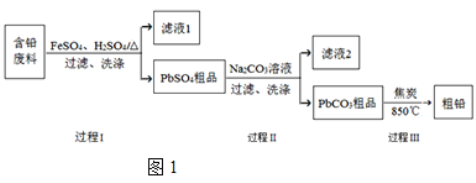
已知:Ksp(PbSO4)=1.6×105,Ksp(PbCO3)=3.3×1014。
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是 。
(2)过程Ⅰ中,Fe2+ 催化过程可表示为:
ⅰ.2Fe2++PbO2+4H++SO42==2Fe3++PbSO4+2H2O
ⅱ.……
①写出ⅱ的离子方程式 。
②下列实验方案可证实上述催化过程,将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红;b. 。
(3)过程Ⅱ的目的是脱硫。若滤液2中c(SO42)=1.6 molL1,c(CO32)=0.1 molL1,则PbCO3中____ (填“是”或“否”)混有PbSO4。
(4)为测定粗产品的纯度,可用EDTA(简写为Y4)标准溶液滴定,反应的离子方程式为:Pb2++Y4==PbY2。测定时,先称取0.2500 g粗铅,溶于足量稀硝酸,以试剂掩蔽少量干扰离子,用0.0500 mol·L1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液23.00 mL,则粗产品中铅的含量为 (以质量分数表示)。
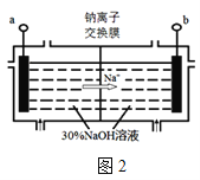
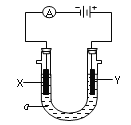
(5)钠离子交换膜固相电解法是从含铅废料中提取铅的一种新工艺,其装置如图2所示。将含铅废料投入阴极室,含铅废料中的PbSO4与NaOH溶液发生反应:PbSO4+3OH=HPbO2+SO42+H2O。
①b与外接电源的 极相连。
②电解过程中,PbO2、PbO、HPbO2在阴极放电,其中PbO2放电的电极反应式为 。
③与传统无膜固相电解法相比,使用钠离子交换膜可以提高Pb元素的利用率,原因是 。
【答案】(1)![]()
(2)①2Fe3++Pb+SO42 == PbSO4+2Fe2+ (2分)
②取a中红色溶液少量,加入足量Pb,充分反应后,红色褪去(2分)
(3)否 (2分)
(4)95.2% (2分)
(5)①负(1分)
②PbO2+4e+2H2O=Pb+4OH (2分)
③阻止HPbO2进入阳极室被氧化(2分)
【解析】(1)从工艺流程图可知,过程Ⅰ中,在Fe2+催化下,Pb、PbO2和H2SO4反应生成PbSO4和水,化学方程式为:![]() 。
。
(2)①催化剂的催化原理是:催化剂参与化学反应生成中间产物,中间产物继续反应又得到催化剂,整个过程中催化剂本身的质量和化学性质在反应前后保持不变。Fe2+为催化剂,被反应物之一的PbO2氧化为Fe3+,即发生反应ⅰ,作为中间产物的Fe3+在后续反应中应被还原为Fe2+,所以反应ⅱ为Pb还原Fe3+的反应,氧化产物Pb2+与SO42结合生成不溶于水的PbSO4,则反应ⅱ的离子方程式为2Fe3++Pb+SO42 == PbSO4+2Fe2+ 。
②a实验证明发生反应i,则b实验需证明发生反应ii,实验方案为:a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红,亚铁离子被氧化为铁离子;b.取a中红色溶液少量,加入过量Pb,把Fe3+还原为Fe2+,使化学平衡Fe3++3SCN![]() Fe(SCN)3逆向移动,红色褪去。故答案为:取a中红色溶液少量,加入足量Pb,充分反应后,红色褪去。
Fe(SCN)3逆向移动,红色褪去。故答案为:取a中红色溶液少量,加入足量Pb,充分反应后,红色褪去。
(3)已知Ksp(PbCO3)=3.3×1014,因有PbCO3沉淀生成,则滤液2为PbCO3的饱和溶液,又因c(CO32)=0.1 molL1,则c(Pb2+)=![]() ;又若c(SO42)=1.6 molL1,则c(Pb2+)×c(SO42)=3.3×1013×1.6=5.28×1013<Ksp(PbSO4)= 1.6×105,说明PbSO4在滤液2中未饱和,即PbCO3中没有混入PbSO4。
;又若c(SO42)=1.6 molL1,则c(Pb2+)×c(SO42)=3.3×1013×1.6=5.28×1013<Ksp(PbSO4)= 1.6×105,说明PbSO4在滤液2中未饱和,即PbCO3中没有混入PbSO4。
(4)从反应的离子方程式可知,Pb与EDTA以等物质的量反应,故粗产品中金属铅的百分含量为:![]() 。
。
(5)①根据钠离子向阴极移动知,b为阴极,则b 电极与电源负极相连。
②电解过程中,PbO2在阴极得电子生成金属Pb,电极反应式为:PbO2+4e+2H2O=Pb+4OH。
③钠离子交换膜只允许钠离子通过,阻止HPbO2进入阳极室被氧化,从而提高Pb元素的利用率。

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
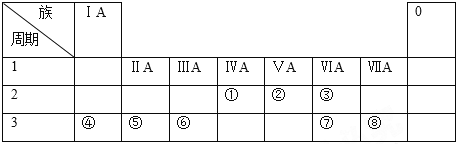
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】化学在生活中有着广泛的应用,下列对应关系正确的是
选项 | 化学性质 | 实际应用 |
A | FeCl3溶液显酸性 | 脱除燃气中H2S |
B | Na2S溶液显碱性 | 去除废水中Cu2+,Hg2+ 等 |
C | 活性炭具有还原性 | 用作自来水的净化剂 |
D | NaC1O2具有氧化性 | 脱除烟气中的SO2及NOx |
A. AB. BC. CD. D
【题目】现有部分元素的性质与原子(或分子)结构如图:
元素符号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第3周期元素的简单离子中半径最小 |
(1)画出元素T的原子结构示意图___________。
(2)元素Y与元素Z相比,金属性较强的是_________(用元素符号表示),下列表述中
能证明这一事实的是_________(填序号)。
A、Y单质的熔点比Z单质低 B、Y的化合价比Z低
C、Y单质与水反应比Z单质剧烈 D、Y的最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性键的化合物,写出该化合物的化学式____________。
(4)元素T和氢元素以原子个数比1:1化合物形成的化合物的电子式______________。