题目内容
4.(I)在一个容积固定不变的密闭容器中进行反应:2X(g)+Y(g)?2Z(g),已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol.回答下列问题:(1)若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H< 0; 熵变△S<0 ( 填:“<,>,=”).该反应在低温(填高温或低温)条件下能自发进行.

(2)该反应的v-t图象如图2中左图所示.若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图2中右图所示.以下说法正确的是②③⑤
①a1>a2 ②b1<b2 ③t1>t2 ④右图中阴影部分面积更大⑤两图中阴影部分面积相等
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如图3所示.下列说法正确的是BD.
A. A、C两点的反应速率:A>C B. A、C两点的气体密度:A<C
C. B、C两点的气体的平均相对分子质量:B<C D. 由状态B到状态A,可以用加热的方法

(II)在容积可变的密闭容器中发生反应:mA(g)+nB(g)?pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
(2)维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是(a+b)mol.
(3)其他条件相同时,在上述三个压强下分别发生该反应.2×105 Pa时,A的转化率随时间变化如图4,请在图4中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图4上画出曲线并标出相应压强).
分析 (Ⅰ)(1)正反应为气体物质的量减小的反应,容器的容积不变,由图可知,状态Ⅱ的压强大于状态Ⅰ压强的2倍,反应在绝热条件下进行,说明正反应为放热反应;正反应后气体的物质的量减少,所以混乱度减小,△H-T△S<0反应自发进行;
(2)加入催化剂,反应速率加快,到达平衡的时间缩短,平衡不移动,阴影部分为反应物浓度变化量,则两图中阴影部分面积相等;
(3)A.A、C两点都在等温线上,压强越大,反应速率越快;
B.A、C两点都在等温线上,反应前后气体物质的量不变,压强越大,容器的容积越小,而混合气体总质量不变;
C.B、C两点X的体积分数相同,则相同组分的体积分数相同;
D.压强相同,升高温度,化学平衡向吸热反应移动;
(Ⅱ)(1)由表格数据可知,当压强从2×105Pa增大为5×105Pa时,压强增大2.5倍,体积变为 $\frac{1}{2.5}$倍,浓度由0.08增大为0.20mol•L-1,也增大2.5倍,所以增大压强平衡不移动;
(2)由(1)可知,增大压强平衡不移动,所以反应前后气体的物质的量不变;
(3)2×105与5×105 Pa时A的转化率不变,但5×105 Pa时反应速率快,到达平衡时间缩短.当压强从5×105Pa增大为1×106Pa时,压强增大2倍,体积变为 $\frac{1}{2}$倍,浓度应该由0.20增大为0.40mol•L-1,但是实际上A的浓度为0.44,说明平衡逆向移动,此时B不是气体,A的转化率减小,反应速率增大,时间缩短.
解答 解:(Ⅰ)(1)正反应为气体物质的量减小的反应,容器的容积不变,由图可知,状态Ⅱ的压强大于状态Ⅰ压强的2倍,反应在绝热条件下进行,说明正反应为放热反应,则△H<0;正反应后气体的物质的量减少,所以混乱度减小,则△S<0,△H-T△S<0反应自发进行,该反应在低温条件下能自发进行,
故答案为:<;<;低温;
(2)加入催化剂,反应速率加快,所以b1<b2,到达平衡的时间缩短,所以t1>t2,平衡不移动,阴影部分为反应物浓度变化量,则两图中阴影部分面积相等,
故答案为:②③⑤;
(3)A. A、C两点都在等温线上,压强A点小于C点,压强越大速率越快,所以反应速率A<C,故A错误;
B. A、C两点都在等温线上,反应前后气体物质的量不变,压强越大,容器的容积越小,而混合气体总质量不变,所以气体密度:A<C,故B正确;
C. B、C两点X的体积分数相同,则相同组分的体积分数相同,所以气体的平均相对分子质量相同,故C错误;
D. 由状态B到状态A,压强相同,温度不同,正反应为放热反应,升高温度化学平衡向吸热反应移动,X的体积分数增大,所以可以通过升温使状态B到状态A,故D正确;
故答案为:BD;
(Ⅱ)(1)由表格数据可知,当压强从2×105Pa增大为5×105Pa时,压强增大2.5倍,体积变为 $\frac{1}{2.5}$倍,浓度由0.08增大为0.20mol•L-1,也增大2.5倍,所以增大压强平衡不移动,
故答案为:不;
(2)由(1)可知,增大压强平衡不移动,所以反应前后气体的物质的量不变,所以当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是a+b,
故答案为:a+b;
(3)2×105与5×105 Pa时A的转化率不变,但5×105 Pa时反应速率快,到达平衡时间缩短.当压强从5×105Pa增大为1×106Pa时,压强增大2倍,体积变为 $\frac{1}{2}$倍,浓度应该由0.20增大为0.40mol•L-1,但是实际上A的浓度为0.44,说明平衡逆向移动,此时B不是气体,A的转化率减小,反应速率增大,时间缩短,A的转化率随时间的变化曲线为: ,
,
故答案为: .
.
点评 本题考查化学平衡影响因素、平衡图象等,综合性较强,侧重考查了学生分析数据、图象获取信息的能力,难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 是碳元素的三种同位素 | |
| B. | 是不同的原子 | |
| C. | 化学性质完全不同 | |
| D. | 其中的 14C和14N所含的质量数相等 |
 某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示.
某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示.可能大量含有的阳离子H+、Ag+、Mg2+、Al3+、NH4+、Fe3+
可能大量含有的阴离子CO32-、AlO2-、NO3-
为探究其成分,进行了以下实验:
探究一:取10mL该混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示.
探究二:取1L该混合溶液,向该溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示.
| Cl2的体积(标准状况) | 5.6L | 11.2L | 22.4L |
| n(Cl-) | 2.5mol | 3.0mol | 4.0mol |
| n(Br-) | 3.0mol | 2.8mol | 1.8mol |
| n(I-) | X mol | 0 | 0 |
| A. | X=0.3 | |
| B. | 溶液中n(Cl-):n(Br-):n(I-)=10:15:4 | |
| C. | 加入的氢氧化钠溶液的浓度为1.45mol•L-1 | |
| D. | 溶液中大量存在的离子共有六种 |
| A. | 反应2CO(g)+2NO(g)═N2(g)+2CO2(g)在298℃时能自发进行,则它的△H>0 | |
| B. | 电解含Mg(NO3)2和Cu(NO3)2的水溶液,阴极上阳离子得电子顺序是Cu2+、H+、Mg2+ | |
| C. | 电解精炼铜的整个过程中,阳极质量的减少量与阴极质量的增加量相等 | |
| D. | 用50mL针筒抽取30mL红棕色的NO2气体并封住注射孔,当用力推压活塞,压缩针筒中的气体(此过程中不考虑温度变化),从针筒顶端观察,气体颜色逐渐变浅 |
| A. | HCl→Cl2 | B. | H2S→SO2 | C. | Fe2O3→Fe | D. | CaO→Ca(OH)2 |
| A. | Na2CO3 | B. | AgNO3 | C. | NaHCO3 | D. | 酚酞 |
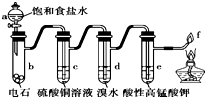
| A. | 用蒸馏水替代a中饱和食盐水产生的乙炔更为纯净 | |
| B. | c(过量)的作用是除去影响后续实验的杂质 | |
| C. | d、e褪色原理相同 | |
| D. | f处产生明亮的蓝色火焰 |
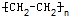 反应类型加聚反应(或聚合反应);
反应类型加聚反应(或聚合反应); 反应类型取代反应
反应类型取代反应 _反应类型加聚反应
_反应类型加聚反应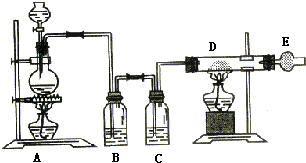 如图是制取无水氯化铜的实验装置图,将分液漏斗中的浓硫酸滴加到盛有固体食盐和二氧化锰混合物的烧瓶中,请回答下列问题:
如图是制取无水氯化铜的实验装置图,将分液漏斗中的浓硫酸滴加到盛有固体食盐和二氧化锰混合物的烧瓶中,请回答下列问题: