题目内容
10.如图是制备和研究乙炔性质的实验装置图,有关说法正确的是( )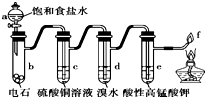
| A. | 用蒸馏水替代a中饱和食盐水产生的乙炔更为纯净 | |
| B. | c(过量)的作用是除去影响后续实验的杂质 | |
| C. | d、e褪色原理相同 | |
| D. | f处产生明亮的蓝色火焰 |
分析 由制备和研究乙炔性质的实验装置图可知,b中饱和食盐水与电石发生CaC2+2H2O→Ca(OH)2+C2H2↑,c中硫酸铜除去杂质硫化氢,d中溴水与乙炔发生加成反应,e中乙炔与高锰酸钾发生氧化反应,最后点燃尾气,以此来解答.
解答 解:A.b中饱和食盐水与电石发生CaC2+2H2O→Ca(OH)2+C2H2↑,为制备乙炔的反应原理,蒸馏水代替氯化钠溶液会使反应速率加快,不容易控制,故A错误;
B.c中硫酸铜除去杂质硫化氢,防止硫化氢对后续实验的影响,故B正确;
C.d中溴水与乙炔发生加成反应生成的有机产物为1,1,2,2-四溴乙烷,e中乙炔与高锰酸钾发生氧化反应,高锰酸钾溶液褪色可说明乙炔能被氧化,反应原理不同,故C错误;
D.c中已经排除杂质的干扰,e中乙炔与高锰酸钾发生氧化反应,高锰酸钾溶液褪色可说明乙炔能被氧化,f处若剩余气体应为乙炔,燃烧放出明亮火焰,冒黑烟,故D错误;
故选B.
点评 本题考查物质的制备及性质实验的设计,为高频考点,把握实验装置的作用、反应原理为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
4.(I)在一个容积固定不变的密闭容器中进行反应:2X(g)+Y(g)?2Z(g),已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol.回答下列问题:
(1)若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H< 0; 熵变△S<0 ( 填:“<,>,=”).该反应在低温(填高温或低温)条件下能自发进行.

(2)该反应的v-t图象如图2中左图所示.若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图2中右图所示.以下说法正确的是②③⑤
①a1>a2 ②b1<b2 ③t1>t2 ④右图中阴影部分面积更大⑤两图中阴影部分面积相等
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如图3所示.下列说法正确的是BD.
A. A、C两点的反应速率:A>C B. A、C两点的气体密度:A<C
C. B、C两点的气体的平均相对分子质量:B<C D. 由状态B到状态A,可以用加热的方法

(II)在容积可变的密闭容器中发生反应:mA(g)+nB(g)?pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
(1)当压强从2×105 Pa增加到5×105 Pa时,平衡不移动(填:向左,向右,不)
(2)维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是(a+b)mol.
(3)其他条件相同时,在上述三个压强下分别发生该反应.2×105 Pa时,A的转化率随时间变化如图4,请在图4中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图4上画出曲线并标出相应压强).
(1)若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H< 0; 熵变△S<0 ( 填:“<,>,=”).该反应在低温(填高温或低温)条件下能自发进行.

(2)该反应的v-t图象如图2中左图所示.若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图2中右图所示.以下说法正确的是②③⑤
①a1>a2 ②b1<b2 ③t1>t2 ④右图中阴影部分面积更大⑤两图中阴影部分面积相等
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如图3所示.下列说法正确的是BD.
A. A、C两点的反应速率:A>C B. A、C两点的气体密度:A<C
C. B、C两点的气体的平均相对分子质量:B<C D. 由状态B到状态A,可以用加热的方法

(II)在容积可变的密闭容器中发生反应:mA(g)+nB(g)?pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
(2)维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是(a+b)mol.
(3)其他条件相同时,在上述三个压强下分别发生该反应.2×105 Pa时,A的转化率随时间变化如图4,请在图4中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图4上画出曲线并标出相应压强).
18.下列说法正确的是 ( )
| A. | 钢铁发生电化学腐蚀时,负极发生的反应是:Fe-3e-═Fe3+ | |
| B. | 将钢铁与电源的正极相连,可防止钢铁被腐蚀 | |
| C. | 在镀件上镀铜时纯铜作阴极 | |
| D. | 钢铁腐蚀中,吸氧腐蚀比析氢腐蚀更普遍 |
5.下列现象与胶体性质无关的是( )
| A. | 江河入海口三角洲的形成 | B. | 向豆浆中加入石膏可制得豆腐 | ||
| C. | FeCl3溶液呈现黄色 | D. | 不同品牌的墨水不能混用 |
2.化学实验设计或实际操作或储存时,能体现“经济、高效、环保、安全”方案是( )
| A. | Na 着火可以使用泡沫灭火器 | |
| B. | 绿色化学是指有毒气体尾气要经过无毒处理后在排放 | |
| C. | 实验室用浓硫酸溶解铜制备硫酸铜 | |
| D. | 实验室可以适当温度下,使铜片在持续通入空气的稀硫酸中溶解的方法制备硫酸铜 |
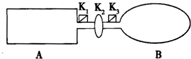 如图装置中,A是由导热材料制成的密闭容器,B是耐化学腐蚀且易于传热的透明气球,关闭K2,将等量的1molNO2通过K1、K3分别充A、B中,反应起始时,A、B的体积相同均为a L.已知:2NO2(g)?N2O4(g)△H<0
如图装置中,A是由导热材料制成的密闭容器,B是耐化学腐蚀且易于传热的透明气球,关闭K2,将等量的1molNO2通过K1、K3分别充A、B中,反应起始时,A、B的体积相同均为a L.已知:2NO2(g)?N2O4(g)△H<0 实验小组用如图所示的实验装置进行实验.
实验小组用如图所示的实验装置进行实验.