题目内容
19.下列有关说法正确的是( )| A. | 反应2CO(g)+2NO(g)═N2(g)+2CO2(g)在298℃时能自发进行,则它的△H>0 | |
| B. | 电解含Mg(NO3)2和Cu(NO3)2的水溶液,阴极上阳离子得电子顺序是Cu2+、H+、Mg2+ | |
| C. | 电解精炼铜的整个过程中,阳极质量的减少量与阴极质量的增加量相等 | |
| D. | 用50mL针筒抽取30mL红棕色的NO2气体并封住注射孔,当用力推压活塞,压缩针筒中的气体(此过程中不考虑温度变化),从针筒顶端观察,气体颜色逐渐变浅 |
分析 A.根据△G=△H-T△S可知,该反应一定为放热才有可能自发;
B.根据电解池里阴极上阳离子的放电顺序来回答;
C.依据电解精炼铜的原理和电极反应分析计算;
D.体积减小,气体的浓度增加,增大压强,化学平衡向着气体系数和减小的方向进行.
解答 解:A.反应2NO+2CO═2CO2+N2,该反应为气体体积减少,△S<0非自发,由△G=△H-T△S可知,该反应一定为放热才有可能自发,即△H<0,故A错误;
B.电解含Mg(NO3)2和Cu(NO3)2的水溶液,溶液显示酸性,阴极上阳离子得电子顺序是Cu2+、H+,Mg2+不会参与放电,故B错误;
C.电解精炼铜时阳极电极反应Cu-2e-=Cu2+,Fe-2e-=Fe2+,Zn-2e-=Zn2+,Ni-2e-=Ni2+,阴极电极反应为Cu2+2e-=Cu,若阴极得到电子数为2NA个,依据电子守恒,阳极失去的电子物质的量为2mol,为几种金属共失去的电子,不是铜失电子物质的量,阳极质量的减少量与阴极质量的增加量一定不相等,故C错误;
D、增大气体压强,平衡向气体体积减小方向移动,即反应向生成N2O4气体的方向移动,所以气体颜色逐渐变浅,故D正确.
故选D.
点评 本题考查化学平衡移动的影响因素、电解池的工作原理、反应的方向等知识,题目难度不大,注意把握反应过程中物质颜色的变化是关键.

练习册系列答案
相关题目
9.下列对于胶体说法错误的是( )
| A. | 用丁达尔效应区别溶液与胶体 | |
| B. | 橄榄油溶于水形成的液体,能发生丁达尔效应 | |
| C. | Al(OH)3胶体可以用来净水,是因为胶体有吸附性 | |
| D. | 胶体区别于其他分散系的本质是分散质粒子直径在10-9m~10-7m |
14.中国江苏网7月23日讯21日晚7时小区门口含有CS2成分废丝品装车时发生爆炸,下列有关CS2的说法正确的是( )
| A. | CS2的电子式为 | |
| B. | 向硫的二硫化碳里加水后振荡,该操作属于萃取 | |
| C. | 少量白磷贮存在二硫化碳中 | |
| D. | 把CS2滴人用硫酸酸化的KMnO4溶液中.有一种淡黄色沉淀析出,同时产生CO2.则相应的化学方程式中CS2与KMnO4的化学计量数之比为5:4. |
4.(I)在一个容积固定不变的密闭容器中进行反应:2X(g)+Y(g)?2Z(g),已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol.回答下列问题:
(1)若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H< 0; 熵变△S<0 ( 填:“<,>,=”).该反应在低温(填高温或低温)条件下能自发进行.

(2)该反应的v-t图象如图2中左图所示.若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图2中右图所示.以下说法正确的是②③⑤
①a1>a2 ②b1<b2 ③t1>t2 ④右图中阴影部分面积更大⑤两图中阴影部分面积相等
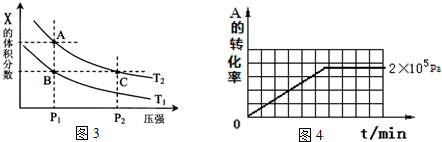
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如图3所示.下列说法正确的是BD.
A. A、C两点的反应速率:A>C B. A、C两点的气体密度:A<C
C. B、C两点的气体的平均相对分子质量:B<C D. 由状态B到状态A,可以用加热的方法
(II)在容积可变的密闭容器中发生反应:mA(g)+nB(g)?pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
(1)当压强从2×105 Pa增加到5×105 Pa时,平衡不移动(填:向左,向右,不)
(2)维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是(a+b)mol.
(3)其他条件相同时,在上述三个压强下分别发生该反应.2×105 Pa时,A的转化率随时间变化如图4,请在图4中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图4上画出曲线并标出相应压强).
(1)若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H< 0; 熵变△S<0 ( 填:“<,>,=”).该反应在低温(填高温或低温)条件下能自发进行.

(2)该反应的v-t图象如图2中左图所示.若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图2中右图所示.以下说法正确的是②③⑤
①a1>a2 ②b1<b2 ③t1>t2 ④右图中阴影部分面积更大⑤两图中阴影部分面积相等
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如图3所示.下列说法正确的是BD.
A. A、C两点的反应速率:A>C B. A、C两点的气体密度:A<C
C. B、C两点的气体的平均相对分子质量:B<C D. 由状态B到状态A,可以用加热的方法

(II)在容积可变的密闭容器中发生反应:mA(g)+nB(g)?pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
(2)维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是(a+b)mol.
(3)其他条件相同时,在上述三个压强下分别发生该反应.2×105 Pa时,A的转化率随时间变化如图4,请在图4中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图4上画出曲线并标出相应压强).
11.下列各组内的两种物质发生反应时,其产物不随反应物用量比的改变而发生变化的是( )
| A. | CO2和澄清石灰水 | B. | NaOH溶液和CO2 | ||
| C. | Na2CO3溶液和盐酸 | D. | NaHCO3溶液和盐酸 |
5.下列现象与胶体性质无关的是( )
| A. | 江河入海口三角洲的形成 | B. | 向豆浆中加入石膏可制得豆腐 | ||
| C. | FeCl3溶液呈现黄色 | D. | 不同品牌的墨水不能混用 |
