题目内容
9.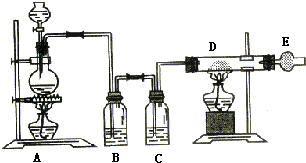 如图是制取无水氯化铜的实验装置图,将分液漏斗中的浓硫酸滴加到盛有固体食盐和二氧化锰混合物的烧瓶中,请回答下列问题:
如图是制取无水氯化铜的实验装置图,将分液漏斗中的浓硫酸滴加到盛有固体食盐和二氧化锰混合物的烧瓶中,请回答下列问题:(1)烧瓶中发生反应的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)B瓶中的溶液是饱和食盐水,其作用是除去氯气中的氯化氢;C瓶中的溶液是浓硫酸,其作用是干燥氯气.
(3)玻璃管D中发生反应的化学方程式为Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2,现象是产生棕黄色的烟.
(4)干燥管E中盛有碱石灰,其作用是吸收未反应完的Cl2,防止空气中的水蒸气进入反应装置.
(5)开始实验时,应先点燃A处的酒精灯.
分析 装置A制备氯气,利用二氧化锰和浓盐酸加热反应生成氯气,氯气中含有氯化氢和水蒸气,需要通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,得到干燥的氯气通入装置D中和铜反应生成氯化铜,装置E是为了防止空气中的水蒸气进入装置影响物质制备,
(1)烧瓶内二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水;
(2)除去氯化氢气体用饱和食盐水;除去水蒸气用浓H2SO4;
(3)装置D中是干燥的氯气和铜在加热时发生反应生成氯化铜;
(4)氯气有毒污染空气,不能排放到空气中,碱石灰有干燥气体和吸收Cl2的作用;
(5)为排除装置中的空气应先点燃A,空气排净后再点燃另一处的酒精灯.
解答 解:(1)加热条件下,二氧化锰和浓盐酸反应生成氯化锰、氯气和水,反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)浓盐酸有挥发性,所以制取的氯气中含有氯化氢气体,氯化氢极易溶于水,饱和食盐水中含有氯离子,能抑制氯气的溶解,所以装置B应该选用饱和食盐水; 氯气能和碱反应,且浓硫酸有吸水性,所以选用浓H2SO4作干燥剂,
故答案为:饱和食盐水;除去氯气中的氯化氢;浓硫酸;干燥氯气;
(3)装置D中是干燥的氯气和铜加热发生的反应,产生了棕黄色的烟,发生反应的化学方程式为:Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2,
故答案为:Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2;产生棕黄色的烟;
(4)氯气有毒,所以尾气不能直接排空,应该选用碱性物质吸收;空气中含有水蒸气,为得到较干燥的氯化铜,应该在氯气和铜的反应处加一个干燥装置,二者作用兼备,所以碱石灰的作用是吸收未反应完的Cl2,防止空气中的水蒸气进入反应装置,
故答案为:吸收未反应完的Cl2,防止空气中的水蒸气进入反应装置;
(5)为排除空气对该氯气和铜反应的影响,应先点燃A处酒精灯,当D中充满黄绿色的气体后再点燃另一处酒精灯,
故答案为:A.
点评 本题考查了氯气、氯化铜的制备实验,难度中等,要根据实验目的选取实验装置、实验药品,是学习的难点,也是高考的热点.

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案(1)若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H< 0; 熵变△S<0 ( 填:“<,>,=”).该反应在低温(填高温或低温)条件下能自发进行.

(2)该反应的v-t图象如图2中左图所示.若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图2中右图所示.以下说法正确的是②③⑤
①a1>a2 ②b1<b2 ③t1>t2 ④右图中阴影部分面积更大⑤两图中阴影部分面积相等
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如图3所示.下列说法正确的是BD.
A. A、C两点的反应速率:A>C B. A、C两点的气体密度:A<C
C. B、C两点的气体的平均相对分子质量:B<C D. 由状态B到状态A,可以用加热的方法

(II)在容积可变的密闭容器中发生反应:mA(g)+nB(g)?pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
(2)维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是(a+b)mol.
(3)其他条件相同时,在上述三个压强下分别发生该反应.2×105 Pa时,A的转化率随时间变化如图4,请在图4中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图4上画出曲线并标出相应压强).
| A. | 钢铁发生电化学腐蚀时,负极发生的反应是:Fe-3e-═Fe3+ | |
| B. | 将钢铁与电源的正极相连,可防止钢铁被腐蚀 | |
| C. | 在镀件上镀铜时纯铜作阴极 | |
| D. | 钢铁腐蚀中,吸氧腐蚀比析氢腐蚀更普遍 |
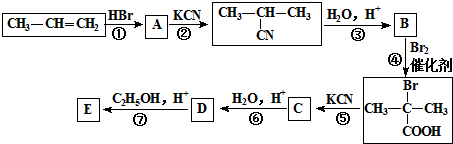
 ;
;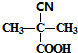
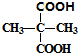 +2C2H5OH$→_{△}^{浓硫酸}$
+2C2H5OH$→_{△}^{浓硫酸}$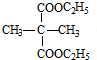 +2H2O.
+2H2O. 与足量NaOH溶液反应的化学方程式为
与足量NaOH溶液反应的化学方程式为 .
.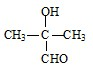 、
、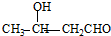 .
.

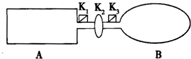 如图装置中,A是由导热材料制成的密闭容器,B是耐化学腐蚀且易于传热的透明气球,关闭K2,将等量的1molNO2通过K1、K3分别充A、B中,反应起始时,A、B的体积相同均为a L.已知:2NO2(g)?N2O4(g)△H<0
如图装置中,A是由导热材料制成的密闭容器,B是耐化学腐蚀且易于传热的透明气球,关闭K2,将等量的1molNO2通过K1、K3分别充A、B中,反应起始时,A、B的体积相同均为a L.已知:2NO2(g)?N2O4(g)△H<0