题目内容
在体积固定的密闭容器中N2与H2发生反应:N2(g)+3 H2 2 NH3
2 NH3
达到平衡时c (N2)=3.5 mol·L-1,c (H2)=1 mol·L-1,c (NH3)=5 mol·L-1,求:
(1)N2和H2的起始浓度(4分)
(2)N2的转化率(2分)(要求有解题过程)
(1)6mol·L-1,8.5mol·L-1 (2)41.67%
解析试题解析:(1)根据物质参加反应时各物质的物质的量之比等于化学方程式中化学计量数之比,因此由平衡时氨气的浓度可计算出反应过程中氮气、氢气消耗的浓度,加上平衡时的浓度可得初始浓度。
(2)转化率=消耗的浓度/初始浓度×100%,可求出氮气的转化率。解题步骤如下:
解:(1)N2和H2的起始浓度分别为6mol·L-1,8.5mol·L-1 (共4分)
(2)N2的转化率41.67% (2分)
(1)设N2与H2发开始浓度分别为x、y,转化为n,则
N2(g)+3H2(g)?2NH3(g),
开始 x y 0
转化 n 3n 2n
平衡3.5 1 5
2n=5,解得n=2.5,
所以x=3.5+2.5=6mol/L,
y=1+3×2.5=8.8mol/L,
答:N2和H2的起始浓度分别为6mol?L-1、8.5mol?L-1;
(2)N2的转化率为:2.5mol/L/6mol/L×100%=41.67%。
考点:考查利用“三段式”法进行化学平衡的有关计算

 阅读快车系列答案
阅读快车系列答案将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入0.5 L密闭容器内,550℃时,在催化剂作用下发生反应:2SO2(g)+O2(g) 2SO3(g)(正反应放热)。测得n(O2)随时间的变化如下表
2SO3(g)(正反应放热)。测得n(O2)随时间的变化如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(O2)/mol | 0.7 | 0.4 | 0.3 | x | x | x |
反应达到5s后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了22.4L(此体积为标准状况下的体积);再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(此体积为标准状况下的体积)。
请回答下列问题:
(1)用O2表示从0~1s内该反应的平均反应速率为 ;
(2)O2的平衡浓度c(O2)= ;
(3)4s时,SO2的生成速率____________(填“大于”、“小于”或“等于”)O2的消耗速率。
(4)求该反应达到平衡时SO2的转化率是____________(用百分数表示)。
(5)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀____________克(计算结果保留一位小数)。
已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。若再加入双氧水,将发生反应:H2O2+2H++2I—→2H2O+I2,且生成的I2立即与试剂X反应而被消耗。一段时间后,试剂X将被反应生成的I2完全消耗。由于溶液中的I—继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝。因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应H2O2+2H++2I—→2H2O+I2的反应速率。
下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
| 编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 开始变蓝时间(min) | ||||
| 0.1 mol·Lˉ1 KI溶液 | H2O | 0.01 mol·Lˉ1 X溶液 | 0.1 mol·Lˉ1 双氧水 | 1 mol·Lˉ1 稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I—→2H2O+I2反应速率的影响。实验2中m= ,n= 。
(2)已知,I2与X反应时,两者物质的量之比为1∶2。按面表格中的X和KI的加入量,加入V(H2O2)>________,才确保看到蓝色。
(3)实验1,浓度c(X)~ t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出实验3、实验4,c(X)~ t的变化曲线图(进行相应的标注)。
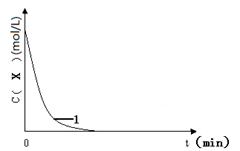
(4)实验3表明:硫酸铁能提高反应速率。催化剂能加快反应速率是因为催化剂 (填“提高”或“降低”)了反应活化能。
(5)环境友好型铝—碘电池已研制成功,已知电池总反应为:2Al(s)+3I2(s)
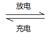 2AlI3(s)。含I—传导有机晶体合成物作为电解质,该电池负极的电极反应为:______________________________,充电时Al连接电源的___________极。
2AlI3(s)。含I—传导有机晶体合成物作为电解质,该电池负极的电极反应为:______________________________,充电时Al连接电源的___________极。 某学生为了探究锌与盐酸反应过程中速率变化。在100mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)在0~1、1~2、2~3、3~4、4~5 min时间段中,反应速率最大的时间段是 ,原因为 ;反应速率最小的时间段是 ,原因为 。
(2)在2~3min时间段内,用盐酸的浓度变化表示的反应速率为 。
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液:
A .蒸馏水 B .Na2SO4溶液 C. NaNO3溶液 D. CuSO4溶液 E. Na2CO3 溶液,
你认为可行的是 。
 2SO3(g)是生产硫酸的主要反应之一。下表是原料气按
2SO3(g)是生产硫酸的主要反应之一。下表是原料气按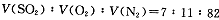 投料,在
投料,在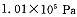 时,不同温度下SO2的平衡转化率。
时,不同温度下SO2的平衡转化率。
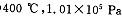 时,将含10 mol SO2的原料气通入一密闭容器中进行反应平衡时SO2的物质的量是 mol。
时,将含10 mol SO2的原料气通入一密闭容器中进行反应平衡时SO2的物质的量是 mol。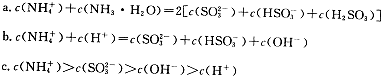

 N2O3 + O2,N2O3又可按下列分解: N2O3
N2O3 + O2,N2O3又可按下列分解: N2O3
 CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。求:
CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。求: