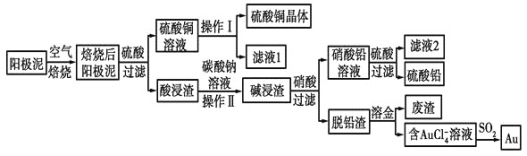
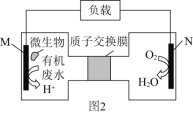
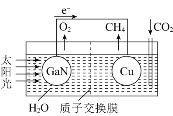
题目内容
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,33.6LHF中含有氟原子的数目为1.5NA
B.2.8gCO与C2H4的混合气体中所含分子数为0.1NA
C.50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
D.含1molFeCl3的氯化铁溶液完全水解生成Fe(OH)3胶体,其中胶粒数为NA
【答案】B
【解析】
A.标准状况下,HF为液体,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B.CO与C2H4摩尔质量都是28g/mol,2.8gCO与C2H4的混合气体中所含分子数为![]() ×NA=0.1NA,故B正确;
×NA=0.1NA,故B正确;
C.50 mL 18.4 mol/L浓硫酸中含有硫酸0.05L×18.4 mol/L =0.92mol,浓硫酸和Cu在加热条件下反应,而稀硫酸和Cu不反应,反应到一定程度后,浓硫酸变为稀硫酸,不能再反应生成二氧化硫,所以50 mL 18.4 mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目小于0.46 NA,故C错误;
D.氢氧化铁胶粒是多个氢氧化铁的集合体,1molFeCl3完全水解转化为氢氧化铁胶体后能生成胶粒小于NA个,故D错误;
故选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】下列实验操作、现象、解释或结论均正确的是
| 实验操作 | 现象 | 解释或结论 |
A. | 向 | 出现白色沉淀 |
|
B. | 向1mL淀粉溶液中滴加 | 溶液不变蓝 | 淀粉已完全水解 |
C. | 往 | 产生大量浅黄色沉淀 | X为溴原子 |
D. | 往新制氯水中滴加几滴紫色石蕊试液 | 溶液变红 | 新制氯水呈酸性 |
A.AB.BC.CD.D