题目内容
【题目】氮和硫的氧化物的综合利用是目前研究的热点之一。回答下列问题:
I.NO2可以分解成物质的量之比为1:1的两种氮的氧化物,,其中还原产物的化学式可能为___。
II.已知:
i.N2(g)+O2(g)![]() 2NO(g) △H=+180.0 kJ·mol-1
2NO(g) △H=+180.0 kJ·mol-1
ii.2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
iii.2NO(g)+O2(g)![]() 2NO2(g) △H=-113.0 kJ·mol-1
2NO2(g) △H=-113.0 kJ·mol-1
(1)反应iV:2NO2(g)+2SO2(g)![]() 2SO3(g)+N2(g)+O2(g)的 △H=__________;该反应在密闭容器中达到平衡后,只改变下列条件,一定能使N2的平衡体积分数增大的是__________(填选项字母)。
2SO3(g)+N2(g)+O2(g)的 △H=__________;该反应在密闭容器中达到平衡后,只改变下列条件,一定能使N2的平衡体积分数增大的是__________(填选项字母)。
A.缩小容器容积 B.再充入SO2 C.降低温度 D.分离出SO3
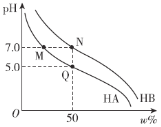
(2)T1°C时,容积相等的密闭容器中分别充入NO2和SO2的混合气体4 mol,发生反应iV。NO2或SO2的平衡转化率(a)与起始充入的![]() 关系如图1所示。
关系如图1所示。

①图中能表示平衡时a(SO2)与起始充入的![]() 关系的曲线为__________(填“L1”或“L2”),理由为___________________;
关系的曲线为__________(填“L1”或“L2”),理由为___________________;
②反应的平衡常数K=________。
(3)向密闭容器中充入一定量SO2和O2,发生反应ii。SO3的平衡体积分数(φ)与温度(T)和压强(p)的关系如图2所示。
①p1、p2、p3由大到小的顺序为_______________。
②P.Q两点对应状态下,单位体积内反应物活化分子数目:P__________Q(填“>”、“<”或“=”),判断依据为____________________________。
【答案】N2O3或NO -263.6 kJ/mol CD L2 随着起始充入的![]() 增大,SO2的平衡转化率增大
增大,SO2的平衡转化率增大 ![]() p1>p2>p3 > P点状态的压强更大,温度更高
p1>p2>p3 > P点状态的压强更大,温度更高
【解析】
I.NO2可以分解成两种含氮氧化物,物质的量之比为1:1,根据氧化还原反应,NO2中氮元素化合价既升高又降低,则其中一种氧化物为N2O5,根据电子守恒和元素守恒可得另一种可能为N2O3或NO且在反应中作还原剂;
II.(1)已知:i.N2(g)+O2(g)![]() 2NO(g) △H=+180.0 kJ·mol-1
2NO(g) △H=+180.0 kJ·mol-1
ii.2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
iii.2NO(g)+O2(g)![]() 2NO2(g) △H=-113.0 kJ·mol-1
2NO2(g) △H=-113.0 kJ·mol-1
根据盖斯定律:反应iV= ii-i-iii可得:2NO2(g)+2SO2(g)![]() 2SO3(g)+N2(g)+O2(g)的 △H=-263.6kJ/mol;
2SO3(g)+N2(g)+O2(g)的 △H=-263.6kJ/mol;
反应iV 为放热反应,反应前后气体体积不变的平衡体系;
A.缩小容器容积,等于增大压强,由于反应前后气体体积不变,平衡不移动,N2的平衡体积分数不变,故A不符合题意;
B.再充入SO2的量无限大时,N2的平衡体积分数减小,故B不符合题意;
C.降低温度平衡正反应方向移动,N2的平衡体积分数增大,故C符合题意;
D.分离出SO3,气体的总物质的量减少,平衡向正向移动,N2的物质的量增大,从而N2的平衡体积分数增大,故D符合题意;
答案选CD;
(2)①随着起始冲入的![]() 增大,NO2的平衡转化率减小,SO2的平衡转化率增大,故能表示平衡时a(SO2)与起始充入的
增大,NO2的平衡转化率减小,SO2的平衡转化率增大,故能表示平衡时a(SO2)与起始充入的![]() 关系的曲线为L2;
关系的曲线为L2;
②当NO2和SO2的平衡转化率相等时,起始充入的![]() =1,即二者的物质的量均为2mol,由图1可知,此时NO2和SO2的平衡转化率为60%,列“三段式”:
=1,即二者的物质的量均为2mol,由图1可知,此时NO2和SO2的平衡转化率为60%,列“三段式”:

反应的平衡常数K=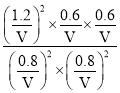 =
=![]() ;
;
(3)①反应ii为气体分子数减小的反应,相同温度下,压强越大,O2的平衡体积分数越大,故p1、p2、p3由大到小的顺序为p1>p2>p3;
②由图像及①分析可得,P、Q两点对应状态下,P点状态的压强更大,温度更高,单位体积内反应物活化分子数目更多,则P>Q。

 阅读快车系列答案
阅读快车系列答案