题目内容
13.理论上不能用设计成原电池的反应是( )| A. | CaO+H2O═Ca(OH)2△H<0 | B. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H<0 | ||
| C. | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4 Fe(OH)3(s)△H<0 | D. | 2H2(g)+O2(g)═2H2O(l)△H<0 |
分析 常温下属于氧化还原反应的放热反应,可设计为原电池,存在元素化合价变化的反应为氧化还原反应,据此回答.
解答 解:A.CaO+H2O═Ca(OH)2不是氧化还原反应,不能设计为原电池,故A选;
B.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H<0属放热的自发氧化还原反应,能设计为原电池,故B不选;
C.4Fe(OH)2(s)+2H2O(l)+O2(g)═4 Fe(OH)3(s)△H<0为放热的自发氧化还原反应,能设计为原电池,故C不选;
D、2H2(g)+O2(g)═2H2O(l)为放热的自发氧化还原反应,能设计为原电池,故D不选;
故选A.
点评 本题考查原电池的构成条件,明确原电池与氧化还原反应的关系是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
4.在1.01×105Pa,150℃条件下,某烃完全燃烧,反应前后压强(体积)不变,该有机物可能是( )
| A. | C2H6 | B. | C6H6 | C. | C2H4 | D. | C2H2 |
1.有pH值都等于4的硝酸和醋酸,均取1mL加水稀释至amL和bmL,测得稀释后溶液的pH均为5,则稀释后溶液的体积( )
| A. | a=b=100mL | B. | a=b=1000mL | C. | a<b | D. | a>b |
8.下列各组物质中都是由分子构成的化合物是( )
| A. | CO2、NO2、SiO2 | B. | HCl、NH3、CH4 | C. | NO、CO、CaO | D. | O2、N2、Cl2 |
5.下列有关气体说法不正确的是( )
| A. | 实验室要收集较纯净CO、NO时只能用排水法 | |
| B. | 实验室用亚硫酸钠与硫酸可制二氧化硫气体 | |
| C. | 用碱石灰可除去氯气中含有的水蒸汽 | |
| D. | 可利用SO2、HCl、HBr气体易溶于水的性质做喷泉实验 |
2.在实验室里,要使Al2(SO4)3溶液中的Al3+全部沉淀出来,应选用( )
| A. | NaOH溶液 | B. | 氨水 | C. | 盐酸 | D. | BaCl2溶液 |
3.下列有关化学用语的表示方法中错误的是( )
| A. | CO2分子的结构式:O=C=O | |
| B. | 次氯酸的电子式: | |
| C. | R2+离子核外有a个电子,b个中子,R原子符合为:${\;}_{a+2}^{a+b+2}$R | |
| D. | S2-的结构示意图: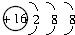 |
 .
.