题目内容
【题目】(1)对于锌—银—稀硫酸组成的原电池装置,当导线中有2mol电子通过时,锌片溶解了______________g ,银片上析出___________升 H2(标准状况下)。
电池总反应的化学方程式为______________。
(2)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如下图所示:

A、B两个电极均由多孔的碳块组成。
该电池的正极反应式为:____________________。若该电池工作时增加了1mol H2O,电路中转移电子的物质的量为_______________。
(3)如果将上述装置中通入的H2改成CH4气体,也可以组成一个原电池装置,则该电池的负极反应式为:____________。
【答案】 65g 22.4L Zn + H2SO4 = ZnSO4 + H2 ↑ O2+2H2O+4e- =4OH- 2mol CH4+10OH-—8e-=CO32-+7H2O
【解析】本题分析:本题主要考查有关原电池的概念判断和计算。
(1)对于锌—银—稀硫酸组成的原电池装置,当导线中有2mol电子通过时,锌呈+2价,锌片溶解了65g ,银片上析出1mol即22.4升 H2(标准状况下)。
电池总反应的化学方程式为Zn + H2SO4 = ZnSO4 + H2 ↑。
(2)该电池的正极通入氧气,正极反应式为:O2+2H2O+4e- =4OH-。若该电池工作时增加了1mol H2O,H2O~2e-,电路中转移电子的物质的量为2mol。
(3)如果将上述装置中通入的H2改成CH4气体,则该电池的负极反应式为:CH4+10OH-—8e-=CO32-+7H2O。

【题目】25 ℃时,几种弱酸的电离常数如下:
弱酸化学式 | HNO2 | CH3COOH | HCN | H2CO3 |
电离常数 | 5.1×10-4 | 1.8×10-5 | 6.2×10-10 | K1=4.4×10-7 K2=4.7×10-11 |
(1)根据上表数据填空:
①物质的量浓度相同的四种酸,其pH由大到小的顺序是___________ (用化学式填写)。
②分别向等体积、相同pH的HCl溶液和CH3COOH溶液中加入足量的Zn粉,反应刚开始时产生H2的速率:v(HCl)______v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:m(H2)盐酸_______m(H2)醋酸。
③将0.2 mol/L HCN溶液与0.1 mol/L Na2CO3溶液等体积混合,发生反应的化学方程式为___________________________。
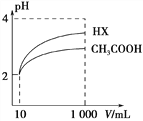
(2)体积均为10 mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程中溶液pH变化如图所示。稀释后,HX溶液中水电离的c(H+)___醋酸溶液中水电离的c(H+) ;电离常数Ka(HX)___Ka(CH3COOH)(填“>”、“=”或“<”)。
(3)CO32- 、 NO2- 、CN-、CH3COO-结合H+的能力由强到弱的顺序为_______________________(用离子符号表示)


