题目内容
【题目】(2016天津)下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题
(1)Z元素在周期表中的位置为__________。
(2)表中元素原子半径最大的是(写元素符号)__________。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1 mol Y单质比1 mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1 mol X的最高价化合物,恢复至室温,放热687 kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式:__________。
(5)碳与镁形成的1mol化合物Q与水反应,生成2 mol Mg(OH)2和1 mol烃,该烃分子中碳氢质量比为9∶1,烃的电子式为__________。Q与水反应的化学方程式为__________。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1 L2.2 mol/L NaOH溶液和1 mol O2,则两种气体的分子式及物质的量分别为__________,生成硫酸铜物质的量为__________。
【答案】
(1)第三周期,ⅦA族
(2)Si
(3)ac
(4)Si(s)+2Cl2(g)=SiCl4(l) △H=-687kJ/mol
(5)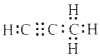 ;Mg2C3+4H2O=2 Mg(OH)2+C3H4↑
;Mg2C3+4H2O=2 Mg(OH)2+C3H4↑
(6)NO 0.9 mol;NO2 1.3 mol;2 mol
【解析】根据元素周期表的结构,可知X为Si元素,Y为O元素;Z为Cl元素;
(1)Cl元素在周期表中位于第三周期,ⅦA族,故答案为:第三周期,ⅦA族;
(2)同一周期,从左到右,原子半径逐渐减小,同一主族,从上到下,原子半径逐渐增大,表中元素原子半径最大的是Si,故答案为:Si;
(3)a.Y单质与H2S溶液反应,溶液变浑浊,说明氧气的氧化性比硫强,从而说明Y元素的非金属性比S元素的非金属性强,正确;b.氧化性的强弱与得电子的多少无关,错误;c.元素的非金属性越强,氢化物越稳定,正确;故选ac;
(4)根据书写热化学方程式的方法,该反应的热化学方程式为Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol,故答案为:Si(s)+2Cl2(g)=SiCl4(l) △H=-687kJ/mol;
(5)该烃分子中碳氢质量比为9∶1,物质的量之比为![]() =
=![]() ,结合碳与镁形成的1mol化合物Q与水反应,生成2 mol Mg(OH)2和1 mol烃,Q的化学式为Mg2C3,烃的化学式为C3H4,电子式为
,结合碳与镁形成的1mol化合物Q与水反应,生成2 mol Mg(OH)2和1 mol烃,Q的化学式为Mg2C3,烃的化学式为C3H4,电子式为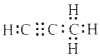 ,Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑,故答案为:
,Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑,故答案为: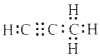 ;Mg2C3+4H2O=2 Mg(OH)2+C3H4↑;
;Mg2C3+4H2O=2 Mg(OH)2+C3H4↑;
(6)铜与一定浓度的硝酸和硫酸的混合酸反应可能生成一氧化氮和二氧化氮,相对分子质量都小于50,符合题意,1 mol O2参与反应转移电子的物质的量为4 mol。假设二氧化氮的物质的量为x,一氧化氮的物质的量为y,则x+y=2.2,x+3y=4,解得x=1.3 mol,y=0.9 mol。参与反应的铜的物质的量为![]() mol=2 mol,因此生成硫酸铜物质的量为2 mol,故答案为:NO 0.9 mol;NO2 1.3 mol;2 mol。
mol=2 mol,因此生成硫酸铜物质的量为2 mol,故答案为:NO 0.9 mol;NO2 1.3 mol;2 mol。

 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案