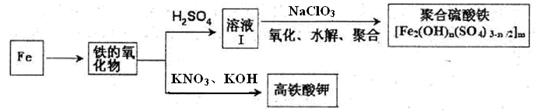
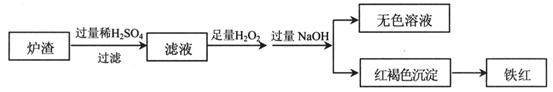
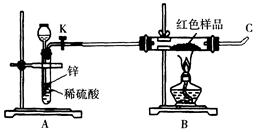
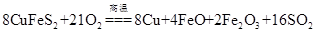题目内容
在硫酸铁溶液中,加入a g铜,完全溶解后,又加入b g铁,充分反应后得到c g残余固体,且b<c,则下列判断正确的是 ( )
| A.最后得到的溶液中含有Fe3+ | B.残余固体可能为铁、铜混合物 |
| C.最后得到的溶液中只含Cu2+ | D.残余固体一定全部是铜 |
B
试题分析:本题涉及的反应有:(1)Cu+2Fe3+==Cu2++2Fe2+,(2)Fe+Cu2+==Fe2++Cu,所以C不正确;由于题目中b<c,说明所加的Fe的量不确定,若Fe的量不足,说明Cu没有被全部置换出来,Cu2+ 没有完全反应掉,故残留固体全部为Cu;若Fe过量,且符合b<c,则残余固体可能为铁、铜混合物,所以B正确,D不正确;因为Fe3+能够氧化Cu,所以当残留固体中有Cu存在时,溶液中一定不含有Fe3+,所以A不正确。故选B。
点评:本题主要考查铁及其化合物的知识,要求会判断反应物与产物,题目难度中等。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目