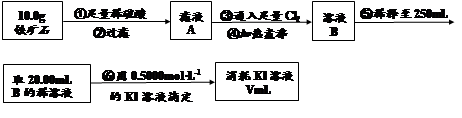题目内容
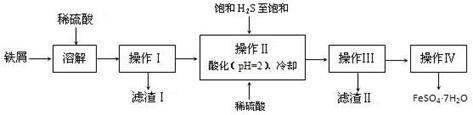
铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某化学探究小组设计如下方案制备上述两种产品:
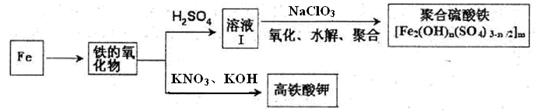
请回答下列问题:
(1)检验固体铁的氧化物中铁的化合价,应使用的试剂是 (填标号)
(2)在溶液Ⅰ中加入NaClO3,写出其氧化Fe2+的离子方程式: 。
(3)Fe2O3与KNO3和KOH的混合物加热共融可制得高铁酸鉀。完成并配平下列化学方程式:
□Fe2O3+□KNO3+□KOH——□ +□KNO2+□ 。
(4)为测定溶液I中铁元素的总含量,实验操作:准确量取20.00mL溶液I于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol·L—1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:2Fe3++2I—=2Fe2++I2、I2+2S2O32—=2I—+S4O62—。
①写出滴定选用的指示剂 ,滴定终点观察到的现象 。
②溶液I中铁元素的总含量为 g·L—1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会 (填“偏高”、“偏低”、“不变”)。

请回答下列问题:
(1)检验固体铁的氧化物中铁的化合价,应使用的试剂是 (填标号)
| A.稀硫酸 | B.稀硝酸 | C.KSCN溶液 | D.酸性高锰酸钾溶液 |
(3)Fe2O3与KNO3和KOH的混合物加热共融可制得高铁酸鉀。完成并配平下列化学方程式:
□Fe2O3+□KNO3+□KOH——□ +□KNO2+□ 。
(4)为测定溶液I中铁元素的总含量,实验操作:准确量取20.00mL溶液I于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol·L—1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:2Fe3++2I—=2Fe2++I2、I2+2S2O32—=2I—+S4O62—。
①写出滴定选用的指示剂 ,滴定终点观察到的现象 。
②溶液I中铁元素的总含量为 g·L—1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会 (填“偏高”、“偏低”、“不变”)。
(1)ACD(2分) (2)6Fe2++ClO3—+6H+=6Fe3++Cl—+3H2O(3分)
(3)1、3、4、2K2FeO4、3、2H2O(3分,写对生成物给1分)
(4)①淀粉(1分) 溶液由蓝色变无色且保持半分钟不变色(2分)
②5.6(2分) 偏高(1分)
(3)1、3、4、2K2FeO4、3、2H2O(3分,写对生成物给1分)
(4)①淀粉(1分) 溶液由蓝色变无色且保持半分钟不变色(2分)
②5.6(2分) 偏高(1分)
试题分析:(1)铁的氧化物是碱性氧化物,能溶于稀硫酸和稀硝酸,但稀硝酸可以将Fe2+氧化为Fe3+,而稀硫酸则不能;Fe3+遇KSCN溶液变红,Fe2+可以使酸性高锰酸钾溶液褪色,故稀硫酸、KSCN溶液、酸性高锰酸钾溶液能检验氧化物中铁的化合价;(2)根据化合价升降相等、电荷守恒、原子守恒可得反应式6Fe2++ClO3—+6H+=6Fe3++Cl—+3H2O;(3)铁元素由+3价升为+6价,氮元素由+5价降为+3价,根据电子守恒、原子守恒可知,1Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O;(4)①淀粉遇I2变蓝,则滴定时指示剂为淀粉;当溶液由蓝色变为无色且半分钟内不变色时,即为滴定终点;②由c?V可知n(S2O32—)=0.1000mol/L×20.00×10—3L,由I2+2S2O32—=2I—+S4O62—可知n(I2)=n(S2O32—)/2=0.1000mol/L×20.00×10—3L÷2,由2Fe3++2I—=2Fe2++I2可知n(Fe3+)=2n(I2)=0.1000mol/L×20.00×10—3L÷2×2,由n?M可知m(Fe)=0.1000mol/L×20.00×10—3L÷2×2×56g/mol,则溶液I中铁元素的总含量为0.1000mol/L×20.00×10—3L÷2×2×56g/mol÷20.00×10—3L=5.6g·L—1;若滴定前H2O2没有除尽,则消耗硫代硫酸钠标准溶液的体积偏大,因此测定结果将偏高。

练习册系列答案
相关题目