题目内容
把等物质的量的Cu、Fe粉投入一定量的FeCl3溶液中充分反应后取出部分溶液,
(1)若滴加一滴KSCN溶液,溶液显红色,则溶液中存在的离子有_________。
(2)若加一滴KSCN溶液,溶液不显红色,则溶液中一定存在的离子有_________,可能存在的金属粉末有_________。
(3)若加入的金属全部溶解,则溶液中n(Cu2+):n(Fe2+)是_________。
(4)若(3)反应后的溶液中有3种金属离子,欲从中回收Cu和FeCl3,需要用到的试剂有(按反应顺序填写)___________________________________。
(1)若滴加一滴KSCN溶液,溶液显红色,则溶液中存在的离子有_________。
(2)若加一滴KSCN溶液,溶液不显红色,则溶液中一定存在的离子有_________,可能存在的金属粉末有_________。
(3)若加入的金属全部溶解,则溶液中n(Cu2+):n(Fe2+)是_________。
(4)若(3)反应后的溶液中有3种金属离子,欲从中回收Cu和FeCl3,需要用到的试剂有(按反应顺序填写)___________________________________。
(9分)(1)Cu2+、Fe2+、Fe3+、Cl- (2)Fe2+、Cl- ;Fe 、Cu (3)1:5
(4)Fe、稀盐酸、Cl2
(4)Fe、稀盐酸、Cl2
试题分析:(1)若滴加一滴KSCN溶液,溶液显红色,说明一定含有铁离子,则铜和铁完全被氧化,因此溶液中存在的离子有Cu2+、Fe2+、Fe3+、Cl-。
(2)若加一滴KSCN溶液,溶液不显红色,说明溶液中不存在铁离子。由于铁的金属性强于铜的,所以铁首先被氧化,则溶液中一定存在的离子有Fe2+、Cl- ,可能存在的金属粉末有铁和铜。
(3)若加入的金属全部溶解,则根据反应式2Fe3++Fe=3Fe2+、2Fe3++Cu=2Fe2++Cu2+可知溶液中n(Cu2+):n(Fe2+)是1:5。
(4)要回收铜,则需要加入过量的铁粉,过滤后,再加入稀盐酸将过量的铁氧化,最后通入氯气将氯化亚铁氧化生成氯化铁,因此需要用到的试剂有(按反应顺序填写)Fe、稀盐酸、Cl2。
点评:该题是高考中的常见题型和考点,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力和发散思维能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是明确反应原理,然后结合题意灵活运用即可。

练习册系列答案
相关题目
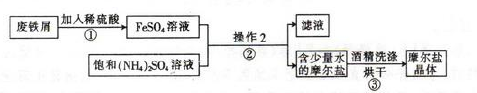
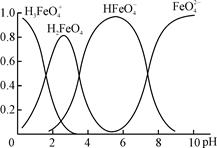
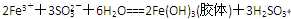 ……
…… 水解能力较
水解能力较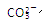 小外,还有___________________________________。
小外,还有___________________________________。