题目内容
18.某无色溶液里只含有下列8种离子中的某几种:Mg2+、H+、Ag+、Na+、Cl-、HCO3-OH-、NO3-.已知:该溶液能跟金属铝反应,且放出的气体只有氢气.试回答:(1)若溶液跟铝反应后只有AlO2-生成,则原溶液一定含有的大量物质是NaOH,发生反应的化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑.还可能含有大量物质是NaCl、NaNO3(写化学式).
(2)若溶液跟铝反应后有Al3+生成,则原溶液中一定不含有的大量离子是Ag+、OH-、HCO3-、NO3-.
分析 跟金属铝反应生成H2的溶液可能为酸溶液,也可能为碱溶液,当生成Al3+时,溶液为酸溶液,当生成AlO2-时,溶液为碱溶液,然后利用离子的共存来分析,并注意离子在水中的颜色.
解答 解:离子均为无色,所有离子均与无色透明溶液符合;铝既能与酸作用产生氢气,也能与碱作用产生氢气,
(1)溶液和铝粉反应后有AlO2-生成,溶液显碱性时,Mg2+、H+、Ag+、HCO3-不能存在,根据溶液不显电性,一定存在阳离子,即阳离子只有Na+,说明原溶液中的阴离子一定含OH-,可能含NO3-、Cl-,反应的化学方程式为,故答案为:NaOH;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;NaCl、NaNO3;
(2)溶液和铝粉反应后有Al3+生成,溶液显酸性,则HCO3-、OH-不存在,由于硝酸与金属反应一般没有氢气产生,因此也不存在NO3-,根据溶液不显电性,一定存在阴离子,即溶液中肯定有Cl-,而Ag+可与Cl-生成沉淀,说明原溶液中也不存在Ag+,即溶液中一定含有大量的H+、Cl-,可能含Na+、Mg2+,一定不能含有:Ag+、OH-、HCO3-、NO3-,故答案为:Ag+、OH-、HCO3-、NO3-.
点评 本题考查物质的检验及离子的共存问题,明确常见离子之间的反应是解答本题的关键,并注意利用溶液为电中性、溶液的酸碱性等来分析解答即可,题目难度不大.

练习册系列答案
 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
8.某元素的原子最外层只有一个电子,它跟卤素原子结合时( )
| A. | 一定形成共价键 | B. | 可能是共价键,也可能是离子键 | ||
| C. | 一定是离子键 | D. | 以上说法都不对 |
9.下列实验设计与结论不相符的是( )
| A. | 某溶液中加入 Ba(NO3)2溶液,再滴加稀盐酸,出现白色沉淀且不溶解,则原溶液中可能含有 SO${\;}_{3}^{2-}$ | |
| B. | 某气体能使湿润的蓝色石蕊试纸变红,则该气体一定是酸性氧化物 | |
| C. | 乙醇中混有乙酸,加氢氧化钠后蒸馏即可得到纯净的乙醇 | |
| D. | 在分液漏斗中加入溴水,然后再加入适量的四氯化碳,振荡后静置,溴可萃取到四氯化碳中 |
3.镁、铁混合物13.4g溶解在足量的稀硝酸中,完全反应得到还原产物只有6.72L(标况下)NO,则向反应后的溶液中加人足量的NaOH溶液,可生成的沉淀质量为( )
| A. | 26.8g | B. | 28.7g | C. | 29.1g | D. | 29.5g |
10.化学中常用图象直观地描述化学反应的进程或结果.下列图象描述正确的是( )
| A. | 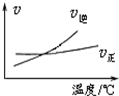 根据图可判断可逆反应“A2(g)+3B2(g)?2AB3(g)”的△H<0 | |
| B. | 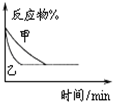 如图表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 | |
| C. | 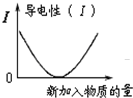 如图可表示醋酸溶液中通入氨气至过量过程中溶液导电性的变化 | |
| D. | 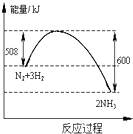 如图④是N2与H2合成氨的能量变化曲线,可确定该反应1mol N2和4molH2充分反应时放热一定等于92kJ |
7.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱.下列反应在水溶液中不可能发生的是( )
| A. | 2 Fe3++2 I-═2 Fe2++I2 | B. | Cl2+FeI2═FeCl2+I2 | ||
| C. | Co2O3+6 HCl═2 CoCl2+Cl2+3 H2O | D. | 3 Cl2+6 FeI2═2 FeCl3+4 FeI3 |
8.一定温度下反应:A2(g)+3B2(g)?2AB3(g)(每生成2mol AB3放出92.4kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1mol A2和3mol B2,达平衡时放出热量为Q1,②通入2mol A2和6mol B2,达平衡时放出热量为Q2,则下列关系正确的是( )
| A. | Q2=2 Q1 | B. | 2Q1<Q2 | C. | Q1<Q2<92.4 kJ | D. | Q1=Q2<92.4 kJ |

 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: