题目内容
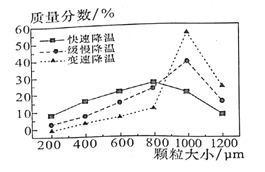
【题目】一定条件下,某可逆反应aA(g) ![]() bB(s)+cC(g)自发进行并达到平衡状态后,A的转化率α(A)与温度(T)、压强(p)的关系如图所示。下列判断正确的是
bB(s)+cC(g)自发进行并达到平衡状态后,A的转化率α(A)与温度(T)、压强(p)的关系如图所示。下列判断正确的是
A.a>b+c
B.该反应的平衡常数随温度的升高而增大
C.T1﹤T2
D.该反应自发进行的温度是低温
【答案】D
【解析】
A. 增大压强,平衡正向移动,则有a>c,A项错误;
B. 该反应能自发进行,则ΔG=ΔH-TΔS<0,因a>c,ΔS<0,那么当ΔH<0时,反应能自发进行,即该反应为放热反应,升高温度,平衡常数K减小,B项错误;
C. 该反应为放热反应,升高温度平衡逆向移动,A的转化率减小,因此T1>T2,C项错误;
D. 该反应能自发进行,则ΔG=ΔH-TΔS<0,当温度较低时,才能自发进行,D项正确;
答案选D。

【题目】根据下列实验操作和现象所得结论正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 测定等浓度的Na2CO3和Na2SO3溶液的pH,Na2CO3的pH大于Na2SO3溶液 | S的非金属性比C强 |
B | 常温下,用pH试纸测得:0.1mol·L-1NaHSO3溶液的pH约为5 |
|
C | 向少量无水乙醇中加入一小粒金属Na,生成可燃性气体 | CH3CH2OH是弱电解质 |
D | 向2mL0.1mol·L-1NaOH溶液中滴加3滴0.1mol·L-1MgCl2溶液,出现白色沉淀后,再滴加3滴0.1mol·L-1FeCl3溶液,出现红褐色沉淀 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
A.AB.BC.CD.D
【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g)→2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应_____(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是____。用O2表示0~1s内该反应的平均速率v=____。

(3)能说明该反应已达到平衡状态的是____(填字母)。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变