题目内容
【题目】为了探究外界条件对反应aX(g)+bY(g)cZ(g)的影响,以X和Y物质的量比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.以下判断正确的是( ) 
A.△H>0,a+b>c
B.△H>0,a+b<c
C.△H<0,a+b>c
D.△H<0,a+b<c
【答案】C
【解析】解:由图象可知,降低温度,Z的物质的量分数增大,说明降低温度平衡向正反应方向移动,所以正反应是放热的,则△H<0,
降低压强,Z的物质的量分数减小,说明压强减小,平衡向着逆反应方向移动,减小压强,化学平衡是向着气体系数和增加的方向进行的,所以有a+b>c,
故选C.
【考点精析】本题主要考查了化学平衡状态本质及特征的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能正确解答此题.

【题目】氨气在工农业生产和国防科技中有着重要应用,科研工作者对其进行着广泛研究。请回答:
(1)某课题组实现了在常温常压下,以氮气和液态水为原料制备氨气,同时有氧气生成。
已知,在一定温度和压强下,由最稳定的单质生成1mol纯物质的热效应,称为该物质的生成热(△H)。常温常压下、相关物质的生成热如下表所示:
物质 | NH3(g) | H2O(l) |
△H /kJ·mol-1 | -46 | -242 |
上述合成氨反应的热化学方程式为______________________________________。
(2)利用生物电池,以H2、N2为原料合成氨的装置如下图所示。

Q、R均为能化剂,据图示判断,负极反应的催化剂为______(填“Q”或“R”);正极的电极反应式为_________________________________________。
(3)氨气是工业制硝酸的主要原料之一,催化氧化步骤中发生的主要反应如下:
I. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)△H=-906kJ/mol
4NO(g)+6H2O(g)△H=-906kJ/mol
II.4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)△H=-1266kJ/mol
2N2(g)+6H2O(g)△H=-1266kJ/mol
将固定比例NH3和O2 的混合气体以一定流速通过填充有催化剂的反应器,反应产率与温度的关系如图1所示。
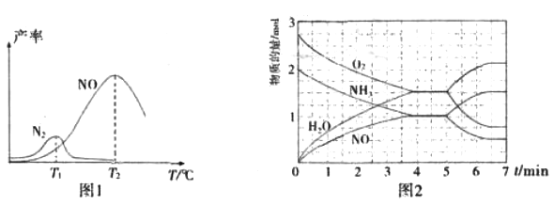
①催化氧化步骤中,最适宜的温度为_________________(填“T1”或“T2”)。
②低于T1℃时,NO的产率较低的原因为_____________________________________。
③高于T2℃时,NO的产率降低的可能原因为______________(填选项字母)
A.催化剂活性降低 B.平衡常数减小
C.反应活化能增大 D.氨气溶于水
④T2℃(T1>T2)时,向20L恒容密闭容器中充人2molNH3和2.75molO2,发生反应
I.反应过程中各物质的物质的量的随时间(t)变化关系如图2所示。
T2℃时,该反应的平衡常数K=________________;5min时,改变了某一外界条件,所改变的条件可能为_________________________________________。
【题目】硫和钙的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态Ca原子中,核外电子占据最高能层的符号是________,该能层为次外层时最多可以容纳的电子数为_________。元素Ca和S相比,第一电离能较大的是______(填元素符号)。
(2)钙元素的焰色反应呈砖红色,其中红色对应的辐射与钾元素的焰色反应对应颜色的辐射波长,较短的是_______(填元素符号)。
(3)H2S和H2O分子构型都为V形,中心原子的杂化形式都是______,但H2O分子键角大于H2S分子,原因是________________。
(4)钙元素和锰元素属于同一周期,且核外最外层电子构型相同,但金属钙的熔点、沸点等都比金属锰低,原因是________________。
(5)Ca、Mn、Mg的氧化物和硫化物都具是NaCl型结构的离子晶体,其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得它们的晶胞参数如下表:
氧化物晶体 | CaO | MnO | MgO |
a/nm | 0.421 | 0.444 | 0.480 |
硫化物晶体 | MgS | MnS | CaS |
a/nm | 0.520 | 0.520 | 0.568 |
由表可知:r(S2-)____r(O2-)(填“>”或“<”),r(Mg2+)、r(Ca2+)、r(Mn2+)由大到小的的顺序是__________,r(S2-)为_____nm,r(Ca2+)为_____nm。

