��Ŀ����
����Ŀ����Ƶ���ػ������ڻ�����ҽҩ�����ϵ��������Ź㷺��Ӧ�á��ش���������:
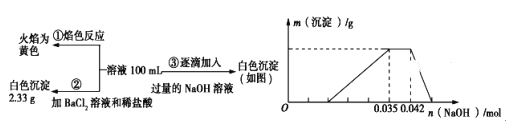
��1����̬Caԭ����,�������ռ������ܲ�ķ�����________�����ܲ�Ϊ�����ʱ���������ɵĵ�����Ϊ_________��Ԫ��Ca��S���,��һ�����ܽϴ����______(��Ԫ�ط���)��
��2����Ԫ�ص���ɫ��Ӧ��ש��ɫ,���к�ɫ��Ӧ�ķ������Ԫ�ص���ɫ��Ӧ��Ӧ��ɫ�ķ��䲨��,�϶̵���_______(��Ԫ�ط���)��
��3��H2S��H2O���ӹ��Ͷ�ΪV��,����ԭ�ӵ��ӻ���ʽ����______,��H2O���Ӽ��Ǵ���H2S����,ԭ����________________��
��4����Ԫ�غ���Ԫ������ͬһ���ڣ��Һ����������ӹ�����ͬ,�������Ƶ��۵㡢�е�ȶ��Ƚ����̵�,ԭ����________________��
��5��Ca��Mn��Mg������������ﶼ����NaCl�ͽṹ�����Ӿ��������������Ӳ��������������ܶѻ���ʽ,X��������ʵ�������ǵľ����������±�:
�����ᄃ�� | CaO | MnO | MgO |
a/nm | 0.421 | 0.444 | 0.480 |
���ᄃ�� | MgS | MnS | CaS |
a/nm | 0.520 | 0.520 | 0.568 |
�ɱ���֪:r(S2-)____r(O2-)(����>������<��),r(Mg2+)��r(Ca2+)��r(Mn2+)�ɴ�С�ĵ�˳����__________,r(S2-)Ϊ_____nm,r(Ca2+)Ϊ_____nm��
���𰸡� N 18 S K sp3�ӻ� OԪ�ص縺�Դ���SԪ�أ�������O-H�����ӶԵĵ����Ƹ�ƫ������Oԭ�ӣ�ʹ�������������� �Ƶ�ԭ�Ӱ뾶�ϴ��Ҽ۵��������٣����������� > r(Ca2+)>r(Mn2+)>r(Mg2+) 0.184 0.100
��������Ca��20��Ԫ�أ�������4�����Ӳ㣬�������ռ������ܲ�ķ�����N, ���ݺ�������Ų����ɣ�����㲻�ܳ���18�����ӣ���һ������S>Mg>Ca,��һ�����ܽϴ����S�ʴ𰸣� N 18 S��
��2����Ԫ�ص���ɫ��Ӧ��ש��ɫ,��Ԫ�ص���ɫ��Ӧ����ɫ����ɫ�ķ��䲨���Ⱥ�ɫ�̣��ʴ𰸣�K��
��3��H2S��H2O���ӹ��Ͷ�ΪV��,����ԭ�ӵ��ӻ������Ŀ����4��������SP3�ӻ���OԪ�صĵ縺�Դ���S,������O-H�����ӶԵĵ���������ԭ�ӣ�ʹ����������H2O���Ӽ��Ǵ���H2S���ӡ��𰸣�sp3�ӻ� OԪ�ص縺�Դ���SԪ�أ�������O-H�����ӶԵĵ����Ƹ�ƫ������Oԭ�ӣ�ʹ�������������� ��
��4���Ƶ�ԭ�Ӱ뾶�ϴ��Ҽ۵��������٣�������������ʹ�ý����Ƶ��۵㣬�е�ȶ��Ƚ����̵ͣ��ʸƵ�ԭ�Ӱ뾶�ϴ��Ҽ۵��������٣�������������
��5���ɱ���֪����ͬ�����ľ��������У�������Ķ�С������ģ����:r(S2-)>r(O2-),���ݲ�ͬ����������ľ�������r(Mg2+)��r(Ca2+)��r(Mn2+)�ɴ�С��˳����r(Ca2+)>r(Mn2+)>r(Mg2+)����ΪS2-��������������ܶѻ���ʽ����Խ�����S2-�뾶��4������4r=![]() 0.520 r=0.184 nm���������Ȼ��ƽṹ�����ݾ����Ľṹ����������=
0.520 r=0.184 nm���������Ȼ��ƽṹ�����ݾ����Ľṹ����������= ![]() ��Ca2+��=
��Ca2+��=![]() =0.100 nm �𰸣�r(Ca2+)>r(Mn2+)>r(Mg2+) 0.184 0.100
=0.100 nm �𰸣�r(Ca2+)>r(Mn2+)>r(Mg2+) 0.184 0.100

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��ijʵ��С������ȡ����ͭ��֤������ͭ�ܼӿ�����صķֽ⣬����������ʵ�飺
��һ����ȡ����ͭ
�ٳ�ȡ2 gCuSO4��5H2O��ϸ�����ձ�����10 mL����ˮ�ܽ⣻
��������CuSO4��Һ����μ���NaOH��Һ��ֱ�����ٲ���������Ȼ�����û����ת�Ƶ���������������ȫ����Ϊ��ɫ��
�۽���������û������ˡ�ϴ�ӣ����ɺ���ϸ���á�
�ش��������⣺
��1������١�������ĥ��������������������__________________��
��2���������ϴ�ӳ����IJ�����____________________________________��
������֤������ͭ�ܼӿ�����صķֽⲢ��������̵Ĵ�Ч�����бȽ���ͼװ�ý���ʵ�飬ʵ��ʱ��������25 mL����Ϊ����������Ӱ��ʵ������ؾ��Ѻ��ԣ�������ݼ��±���

ʵ����� | KClO3���� | ������������ | �������� |
�� | 1.2g | ���������� | |
�� | 1.2g | CuO 0.5g | |
�� | 1.2g | MnO2 0.5g |
�ش��������⣺
��3������ʵ���еġ��������ݡ�ָ__________________��
��4����Ҫ֤��ʵ����и�������ռ���������O2���ɴ������ռ��������õ��ɼм�סB���齺�ܣ���ȥ������ϵ�����Ƥ����____________________________________��
��5��Ϊ̽��CuO��ʵ������Ƿ�������ã��貹������ʵ�飨����д�������������a��_________________________________��b��CuO�Ļ�ѧ������û�иı䡣