题目内容
【题目】氨气在工农业生产和国防科技中有着重要应用,科研工作者对其进行着广泛研究。请回答:
(1)某课题组实现了在常温常压下,以氮气和液态水为原料制备氨气,同时有氧气生成。
已知,在一定温度和压强下,由最稳定的单质生成1mol纯物质的热效应,称为该物质的生成热(△H)。常温常压下、相关物质的生成热如下表所示:
物质 | NH3(g) | H2O(l) |
△H /kJ·mol-1 | -46 | -242 |
上述合成氨反应的热化学方程式为______________________________________。
(2)利用生物电池,以H2、N2为原料合成氨的装置如下图所示。

Q、R均为能化剂,据图示判断,负极反应的催化剂为______(填“Q”或“R”);正极的电极反应式为_________________________________________。
(3)氨气是工业制硝酸的主要原料之一,催化氧化步骤中发生的主要反应如下:
I. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)△H=-906kJ/mol
4NO(g)+6H2O(g)△H=-906kJ/mol
II.4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)△H=-1266kJ/mol
2N2(g)+6H2O(g)△H=-1266kJ/mol
将固定比例NH3和O2 的混合气体以一定流速通过填充有催化剂的反应器,反应产率与温度的关系如图1所示。
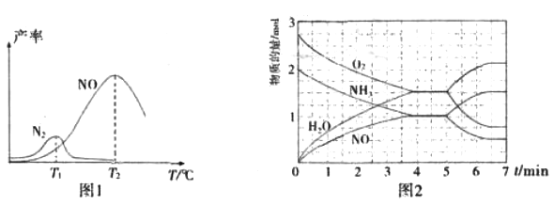
①催化氧化步骤中,最适宜的温度为_________________(填“T1”或“T2”)。
②低于T1℃时,NO的产率较低的原因为_____________________________________。
③高于T2℃时,NO的产率降低的可能原因为______________(填选项字母)
A.催化剂活性降低 B.平衡常数减小
C.反应活化能增大 D.氨气溶于水
④T2℃(T1>T2)时,向20L恒容密闭容器中充人2molNH3和2.75molO2,发生反应
I.反应过程中各物质的物质的量的随时间(t)变化关系如图2所示。
T2℃时,该反应的平衡常数K=________________;5min时,改变了某一外界条件,所改变的条件可能为_________________________________________。
【答案】 2N2(g)+6H2O(l)![]() 3O2(g)+4NH3(g) ΔH=+1268 kJ·mol-1 Q N2+6H++6e-=2NH3 T2 温度较低时,反应速率慢,同时部分反应物生成N2 AB 0.075 升高温度或缩小容器容积
3O2(g)+4NH3(g) ΔH=+1268 kJ·mol-1 Q N2+6H++6e-=2NH3 T2 温度较低时,反应速率慢,同时部分反应物生成N2 AB 0.075 升高温度或缩小容器容积
【解析】(1)考查热化学反应方程式的书写,N2与H2O之间的反应是2N2+6H2O=3O2=4NH3,N2(g)+3H2(g)=2NH3(g),此时热效应是(-46×2)kJ·mol-1,2H2(g)+O2(g)=2H2O(l),此时的热效应是(-242×6)kJ·mol-1,两式变形得到此方法合成氨的热化学反应方程式为2N2(g)+6H2O(l)![]() 3O2(g)+4NH3(g) △H=[-46×4-(-242×6)]kJ·mol-1=+1268kJ·mol-1,即为2N2(g)+6H2O(l)
3O2(g)+4NH3(g) △H=[-46×4-(-242×6)]kJ·mol-1=+1268kJ·mol-1,即为2N2(g)+6H2O(l)![]() 3O2(g)+4NH3(g) ΔH=+1268 kJ·mol-1;(2)考查原电池工作原理和电极反应式的书写,根据原电池工作原理,负极上失去电子,化合价升高,因此通氢气一极为负极,根据装置图,Q为催化剂;通氮气一极为正极,根据工作原理,正极反应式为N2+6H++6e-=2NH3;(3)考查化学反应条件的控制、化学平衡常数的计算、勒夏特列原理,①制取硝酸,NH3与氧气反应生成NO,NO与O2反应生成NO2,NO2与水反应生成HNO3,T2时NO的产率最高,因此最适宜的温度是T2;②低于T1℃时,反应速率慢,同时部分反应物转化成N2,造成NO的产率降低;③A、催化剂活性受温度影响,在一定温度时,催化剂催化效率最高,超过此温度,降低催化剂的催化效率,故A正确;B、根据反应方程式,生成NO的反应是放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,故B正确;C、活化能的大小不影响平衡的移动,故C错误;D、 这里的水为气态水,故D错误;④根据图2,4min时达到平衡,c(NH3)=c(NO)=1/20mol·L-1,c(O2)=c(H2O)=1.5/20mol·L-1,根据化学平衡常数的表达式,K=
3O2(g)+4NH3(g) ΔH=+1268 kJ·mol-1;(2)考查原电池工作原理和电极反应式的书写,根据原电池工作原理,负极上失去电子,化合价升高,因此通氢气一极为负极,根据装置图,Q为催化剂;通氮气一极为正极,根据工作原理,正极反应式为N2+6H++6e-=2NH3;(3)考查化学反应条件的控制、化学平衡常数的计算、勒夏特列原理,①制取硝酸,NH3与氧气反应生成NO,NO与O2反应生成NO2,NO2与水反应生成HNO3,T2时NO的产率最高,因此最适宜的温度是T2;②低于T1℃时,反应速率慢,同时部分反应物转化成N2,造成NO的产率降低;③A、催化剂活性受温度影响,在一定温度时,催化剂催化效率最高,超过此温度,降低催化剂的催化效率,故A正确;B、根据反应方程式,生成NO的反应是放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,故B正确;C、活化能的大小不影响平衡的移动,故C错误;D、 这里的水为气态水,故D错误;④根据图2,4min时达到平衡,c(NH3)=c(NO)=1/20mol·L-1,c(O2)=c(H2O)=1.5/20mol·L-1,根据化学平衡常数的表达式,K= =0.075;根据NH3和O2的物质的量减小,NO和H2O的物质的量增大,说明改变的这一因素,平衡向逆反应方向移动,即升高温度或缩小容器的容积。
=0.075;根据NH3和O2的物质的量减小,NO和H2O的物质的量增大,说明改变的这一因素,平衡向逆反应方向移动,即升高温度或缩小容器的容积。

【题目】用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.2000molL ﹣1的氢氧化钠溶液(指示剂为酚酞),滴定结果如下:
NaOH起始读数 | NaOH终点读数 | |
第一次 | 0.10mL | 18.60mL |
第二次 | 0.30mL | 18.00mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为molL﹣1 .
(2)达到滴定终点的标志是 .
(3)以下操作造成测定结果偏高的原因可能是 .
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管.