ĢāÄæÄŚČŻ
”¾ĢāÄæ”æ°“ŅŖĒóĶź³ÉĻĀĮŠĢīæÕ:
£Ø1£©ÓÉCH4ŗĶO2×é³ÉµÄ»ģŗĻĘųĢåŌŚ±ź×¼×“æöĻĀµÄĆܶČĪŖl g”¤L-1£¬ŌņøĆ»ģŗĻĘųĢåÖŠCH4ŗĶO2µÄĢå»ż±ČĪŖ________”£
£Ø2£©ÓĆ98%(ĆܶČĪŖ1.84g/mL )µÄÅØĮņĖįÅäÖĘ500mL 2.5mol/LµÄĻ”ĮņĖį£¬ŠčÓĆĮæĶ²ĮæČ”ÅØĮņĖįµÄĢå»żĪŖ________mL”£
£Ø3£©Ļņ100mL 0.2mol/L µÄNaAlO2ČÜŅŗÓė300mL 0.1mol/LµÄHClČÜŅŗ»ģŗĻ£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ _________________”£
£Ø4£©Ä³»ģŗĻČÜŅŗÖŠ½öŗ¬ÓŠĄė×Ó£ŗFe2+”¢Cl-”¢Br-”¢I-£¬²āµĆCl-”¢Br-”¢I-µÄĪļÖŹµÄĮæÖ®±ČĪŖ2£ŗ3£ŗ4£¬ĶłČÜŅŗÖŠĶØČėŅ»¶ØĮæµÄĀČĘų£¬³ä·Ö·“Ó¦ŗóČÜŅŗÖŠCl-ŗĶBr-µÄĪļÖŹµÄĮæÖ®±ČĪŖ3£ŗ1£¬ŌņĶØČėµÄĀČĘųµÄĪļÖŹµÄĮæÓėČÜŅŗÖŠŹ£ÓąFe2+µÄĪļÖŹµÄĮæÖ®±ČĪŖ=_________________”££Ø¼ŁÉčČÜŅŗµÄĢå»żŌŚ·“Ó¦Ē°ŗ󲻱䣩
£Ø5£©ĖįŠŌĢõ¼žĻĀ£¬ĻņFeI2µÄµķ·ŪČÜŅŗÖŠ¼ÓČėH2O2ČÜŅŗŗó±äĄ¶”£µ±ÓŠ1mol Fe2+±»Ńõ»Æ³ÉFe3+Ź±£¬×ŖŅʵē×Ó4mol”£Š“³öøĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ_________”£
”¾“š°ø”æ3”Ć2 67.9 6AlO2-+9H++3H2O=5Al(OH)3”ż+Al3+ 7£ŗ3 2Fe2++6I-+4H2O2+8H+=2Fe3++3I2+8H2O
”¾½āĪö”æ
£Ø1£©æÉĄūÓĆ”°Ź®×Ö½»²ę·Ø”±Ą“¼ĘĖć£»
£Ø2£©ĄūÓĆĻ”ŹĶ¶ØĀɼĘĖć¼“æÉ£»
£Ø3£©øł¾Ż·“Ó¦ĪļµÄĪļÖŹµÄĮ棬æÉŅŌĻČÅŠ¶Ļ³ö¹żĮæµÄĪŹĢā£¬ŌŁøł¾ŻŹ£ÓąµÄĮæČ„·ÖĪöŗóŠų·“Ó¦µÄĒéæö£¬×īŗó½«Į½øö»Æѧ·½³ĢŹ½Ļą¼Ó£¬ŌŁ½«ĻµŹż»ÆÕū¼“æÉ£»
£Ø4£©»¹ŌŠŌ£ŗI->Fe2+>Br-£¬ĢāÖŠøęÖŖÓŠFe2+Ź£Óą£¬ŌņĖµĆ÷Cl2²¢Ī“ÓėBr-·“Ó¦£¬ÓÉ“Ė½ųŠŠ¼ĘĖć£»
£Ø5£©ĻČŠ“³öFe2+ŗĶI-·Ö±šÓėH2O2µÄ·“Ó¦·½³ĢŹ½£¬ŌŁøł¾Żµē×Ó×ŖŅĘŹżÄæ·ÖĪöĮ½øö·“Ó¦µÄĻą¹ŲĪļÖŹµÄĮ棬“Ó¶ų»ńµĆ×ܵķ“Ó¦·½³ĢŹ½”£
£Ø1£©ŌŚ±źæöĻĀ£¬¦Ń(CH4)=![]() g”¤L-1£¬¦Ń(O2)=
g”¤L-1£¬¦Ń(O2)=![]() g”¤L-1£¬øł¾ŻŹ®×Ö½»²ę·Ø£ŗ
g”¤L-1£¬øł¾ŻŹ®×Ö½»²ę·Ø£ŗ
 £¬Ōņn(CH4)£ŗn(O2)=3£ŗ2£¬¼“V(CH4)£ŗV(O2)=3£ŗ2£»
£¬Ōņn(CH4)£ŗn(O2)=3£ŗ2£¬¼“V(CH4)£ŗV(O2)=3£ŗ2£»
£Ø2£©ÉčŠčŅŖÅØĮņĖįV mL£¬ŌņÓŠ£ŗ![]() £¬½āµĆV=67.9mL£»
£¬½āµĆV=67.9mL£»
£Ø3£©n(NaAlO2)=0.1L”Į0.2mol/L=0.02mol£¬n(HCl)= 0.3L”Į0.1mol/L=0.03mol£¬ŌņŌŚ·“Ó¦H++AlO2-+H2O=Al(OH)3”żÖŠ£¬H+¹żĮ棻ŌŚ·“Ó¦4H++ AlO2-=Al3++2H2OÖŠ£¬AlO2-¹żĮ棻ĖłŅŌæÉŅŌĶʶĻ³ö·¢Éś·“Ó¦£ŗH++AlO2-+H2O=Al(OH)3”ż£¬¹żĮæµÄH+ŌŁŗĶAl(OH)3·“Ó¦£ŗ3H++ Al(OH)3=Al3++3H2O£»ŌŚµŚŅ»øö·“Ó¦ÖŠ£¬ĻūŗÄ0.02mol H+£¬Éś³É 0.02mol Al(OH)3£¬Ź£Óą0.01 mol H+£¬¼“0.02H++0.02AlO2-+0.02H2O=0.02Al(OH)3”ż£¬ŌŚµŚ¶žøö·“Ó¦ÖŠ£¬0.01mol H+ĶźČ«²Ī¼Ó·“Ó¦£¬ĻūŗÄ![]() mol Al(OH)3£¬Éś³É
mol Al(OH)3£¬Éś³É![]() mol AlO2-£¬¼“0.01H++
mol AlO2-£¬¼“0.01H++![]() Al(OH)3=
Al(OH)3=![]() Al3++0.01H2O£¬½«Į½øö·½³ĢŹ½Ļą¼ÓæÉµĆ£ŗ 0.02AlO2-+0.03H++0.01H2O=
Al3++0.01H2O£¬½«Į½øö·½³ĢŹ½Ļą¼ÓæÉµĆ£ŗ 0.02AlO2-+0.03H++0.01H2O=![]() Al(OH)3”ż+
Al(OH)3”ż+![]() Al3+£¬ĻµŹż»ÆÕūµĆ£ŗ6AlO2-+9H++3H2O=5Al(OH)3”ż+Al3+£»
Al3+£¬ĻµŹż»ÆÕūµĆ£ŗ6AlO2-+9H++3H2O=5Al(OH)3”ż+Al3+£»
£Ø4£©ÉčCl-”¢Br-”¢I-µÄĪļÖŹµÄĮæŅĄ“ĪĪŖ2mol”¢3mol”¢4mol£¬ŌņFe2+µÄĪļÖŹµÄĮæĪŖ![]() mol£»ŅņĪŖ»¹ŌŠŌ£ŗI->Fe2+>Br-£¬ĖłŅŌI-ĻČŗĶCl2
mol£»ŅņĪŖ»¹ŌŠŌ£ŗI->Fe2+>Br-£¬ĖłŅŌI-ĻČŗĶCl2
 £¬Ōņn(Cl2)1=2mol£¬n(Cl-)1=4mol£»
£¬Ōņn(Cl2)1=2mol£¬n(Cl-)1=4mol£»
ÉčŗĶFe2+·“Ó¦µÄĪļÖŹµÄĮæĪŖx mol£¬
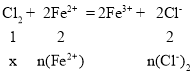 £¬n(Cl-)2=2x mol£¬n(Fe2+)=2x mol£»
£¬n(Cl-)2=2x mol£¬n(Fe2+)=2x mol£»
Ōņ·“Ó¦ŗó£¬ČÜŅŗÖŠCl-µÄĪļÖŹµÄĮæĪŖ(2+4+2x)mol£¬ŅņĪŖ·“Ó¦ŗóCl-ŗĶBr-µÄĪļÖŹµÄĮæ±ČĪŖ3£ŗ1£¬ĖłŅŌÓŠ£ŗ![]() £¬½āµĆx=
£¬½āµĆx=![]() £¬ĶØČėµÄCl2µÄĪļÖŹµÄĮæĪŖ(2+x)=
£¬ĶØČėµÄCl2µÄĪļÖŹµÄĮæĪŖ(2+x)=![]() mol£¬ČÜŅŗÖŠŹ£ÓąFe2+µÄĪļÖŹµÄĮæĪŖ(
mol£¬ČÜŅŗÖŠŹ£ÓąFe2+µÄĪļÖŹµÄĮæĪŖ(![]() )mol=
)mol=![]() mol£¬ĖłŅŌĶØČėµÄĀČĘųµÄĪļÖŹµÄĮæÓėČÜŅŗÖŠŹ£ÓąFe2+µÄĪļÖŹµÄĮæÖ®±ČĪŖ7£ŗ3£»
mol£¬ĖłŅŌĶØČėµÄĀČĘųµÄĪļÖŹµÄĮæÓėČÜŅŗÖŠŹ£ÓąFe2+µÄĪļÖŹµÄĮæÖ®±ČĪŖ7£ŗ3£»
£Ø5£©øĆ¹ż³ĢÉę¼°Į½øö·“Ó¦£ŗH2O2+2H++2Fe2+=2Fe3++2H2OŗĶ2H++H2O2+2I-=I2+2H2O£¬ÕāĮ½øö·“Ó¦Ź½ÖŠ¾ł×ŖŅĘ2e-£»ÓŠ1mol Fe2+±»Ńõ»Æ³ÉFe3+Ź±£¬×ŖŅʵē×Ó4mol£¬ŌņÓŠ2mol Fe2+±»Ńõ»Æ³ÉFe3+Ź±£¬×ŖŅʵē×Ó8mol£¬¶ų2mol Fe2+×ŌÉķŹ§Č„2mol e-£¬ĖłŅŌÓŠ6mol e-ÓÉ6mol I-Ź§Č„£¬¼“·¢Éś·“Ó¦£ŗH2O2+2H++2Fe2+=2Fe3++2H2OŗĶ6H++3H2O2+6I-=3I2+6H2O£¬½«Į½øö·½³ĢĻą¼ÓæÉµĆ£ŗ2Fe2++6I-+4H2O2+8H+=2Fe3++3I2+8H2O”£

”¾ĢāÄæ”æMČÜŅŗŹÜČČ»į·¢Éś·Ö½ā·“Ó¦”£Ģå»ż¾łĪŖ2LµÄ4×éČÜŅŗ(ŗöĀŌ·“Ó¦Ē°ŗóĢå»żµÄ±ä»Æ)£¬MµÄĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»ÆČēĻĀ±ķ£¬ŌņĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
0min | 10min | 20min | 30min | 40min | 50min | 60min | ||
¢Ł | 10”ę | 1.1 | 0.90 | 0.80 | 0.73 | 0.68 | 0.65 | 0.65 |
¢Ś | 10”ę | a | 0.70 | 0.65 | 0.65 | 0.65 | 0.65 | 0.65 |
¢Ū | 25”ę | 1.0 | 0.70 | 0.50 | 0.35 | 0.25 | 0.20 | 0.20 |
¢Ü | 30”ę | 2.0 | 1.4 | 0.90 | 0.50 | 0.20 | 0.13 | 0.13 |
A.ŌŚ10-20minÄŚ£¬ŹµŃé¢ŁÖŠMµÄĘ½¾ł·Ö½āĖŁĀŹĪŖ0.005mol/(L”¤min)
B.a>1.1£¬ĒŅĖµĆ÷ÅضČŌ½“ó·“Ó¦ĖŁĀŹŌ½æģ
C.¶Ō±ČŹµŃé¢ŁŗĶ¢Ü£¬²»ÄÜĖµĆ÷MµÄĘ½¾ł·“Ó¦ĖŁĀŹĖęĪĀ¶ČÉżø߶ųŌö“ó
D.²»æ¼ĀĒĘäĖüÓ°ĻģŅņĖŲ£¬½öÓÉ¢ŪæÉÖŖ£¬·“Ó¦ĪļÅضČŌ½“ó·“Ó¦ĖŁĀŹŌ½æģ
”¾ĢāÄæ”æĶź³ÉĻĀĮŠŹµŃéĖłŃ”ŌńµÄ×°ÖĆ»ņŅĒĘ÷£Ø¼Š³Ö×°ÖĆŅŃĀŌČ„£©ÕżČ·µÄŹĒ£Ø””””£©
Ń”Ļī | A | B | C | D |
ŹµŃé | ÓĆCCl4ĢįČ”äåĖ®ÖŠµÄBr2 | “ÓŹ³ŃĪĖ®ÖŠĢįČ”NaCl¹ĢĢå | “ÓKIŗĶI2µÄ¹ĢĢå»ģŗĻĪļÖŠ»ŲŹÕI2 | ÅäÖĘ100 mL0.1000 mol”¤L£1Na2CO3ČÜŅŗ |
×°ÖĆ»ņŅĒĘ÷ |
|
|
|
|
A.AB.BC.CD.D