题目内容
【题目】常温时,有关稀氨水、铵盐溶液的叙述正确的是
A. 已知0 .10 mo1/ L氨水的电离度为1.32%,该溶液的pH=12
B. 向含有NaOH和NH3·H2O的溶液中加入稀盐酸,溶液呈中性时c(Na+)=c(Cl-)
C. 向10 mL0.1 mo1/L的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中,![]() 将增大
将增大
D. 浓度均为0.1 mol/L的下列溶液①NH4HSO4②NH4Al(SO4)2③NH4Cl④(NH4)2SO4中c(NH4+)的大小关系为①>②>④>③
【答案】C
【解析】
A. 已知0.10 mo1/L氨水的电离度为1.32%,根据电离方程式:NH3H2ONH4++OH-,c(OH-)=0.10 mo1/L×1.32%=1.32×10-3mol/L,则溶液中的c(H+)=![]() =7.58×10-12mol/L,则溶液的pH=-lg c(H+)=-[lg7.58+lg10-12]=(12- lg7.58)<12,故A错误;
=7.58×10-12mol/L,则溶液的pH=-lg c(H+)=-[lg7.58+lg10-12]=(12- lg7.58)<12,故A错误;
B. 加入盐酸至pH=7时,溶液呈中性,即c(H+)=c(OH-),根据电荷守恒得:c(NH4+)+c(Na+)=c(Cl-),即c(Cl-)>c(Na+),故B错误;
C. 向10mL浓度为0.1mo1·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中水的电离程度先增大,随着氨水浓度的增加水的电离被抑制,水的电离程度减小,当向CH3COOH溶液中滴加相同浓度的氨水,开始时溶液为CH3COOH和CH3COONH4的混合物,由CH3COONH4的水解常数Kh= ![]() 可知,随着氨水的加入,c(OH-)逐渐增大,Kh不变,则
可知,随着氨水的加入,c(OH-)逐渐增大,Kh不变,则![]() 逐渐增大,故C正确;
逐渐增大,故C正确;
D. ①NH4HSO4②NH4Al(SO4)2③NH4Cl④(NH4)2SO4溶液中铵根离子浓度④最大,①溶液中氢离子抑制铵根离子水解,③中氯离子对铵根离子水解无影响,②中Al3+也发生水解,在一定程度上抑制铵根离子水解,所以铵根离子浓度为:④>①>③>②,故D错误,
故选C。

【题目】用1.500mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示:
实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
1 | 25.00 | 24.41 |
2 | 25.00 | 24.39 |
3 | 25.00 | 25.90 |
回答下列问题:
(1)量取待测液时,使用25.00ml移液管或______滴定管;
(2)实验中,需要润洗的仪器是:____________________;
(3)取待测液NaOH溶液25.00ml 于锥形瓶中,使用酚酞做指示剂。滴定终点的判断依据是_____________________;
(4)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果__________(填“偏高”“偏低”“不变”,下同);若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果____________。
(5)未知浓度的NaOH溶液的物质的量浓度为__________ mol/L(保留小数点后3位有效数字)。
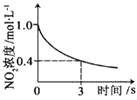
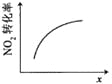
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
升高温度, | 0~3s内,反应速率为: | t1时仅加入催化剂, | 达平衡时,仅改变x,则x为c(O2) |