题目内容
【题目】常温下,pH=11的NaOH溶液和CH3COONa溶液各5 mL,分别稀释至500mL,溶液的pH与溶液体积(V)的关系如图所示,下列说法正确的是

A. a>9
B. 稀释后的溶液耗酸量相等
C. 曲线y表示NaOH溶液的变化
D. N、P、M点对应的溶液中水的电离程度依次增大
【答案】D
【解析】
A. pH=11的NaOH溶液和CH3COONa溶液稀释100倍后,pH都减小,NaOH是强碱,稀释后其pH变化最明显,y减小的程度小于x,则说明x是NaOH溶液,y是CH3COONa溶液,pH=11的强碱NaOH溶液稀释100倍后,pH=9,所以a=9,故A错误;
B. NaOH是强碱在溶液中完全电离,CH3COONa是强碱弱酸盐通过醋酸根离子水解而显碱性,pH相等的NaOH溶液和CH3COONa溶液中n(NaOH)>n(CH3COONa),所以NaOH溶液和CH3COONa溶液与酸完全反应时,消耗同浓度酸的体积V(CH3COONa)<V(NaOH),故B错误;
C. pH=11的NaOH溶液和CH3COONa溶液稀释100倍后,pH都减小,NaOH是强碱,稀释后其pH变化最明显,所以x曲线表示NaOH溶液,故C错误;
D.N点时,NaOH溶液被稀释10倍,P点时,NaOH溶液被稀释100倍,从N点→P点NaOH溶液的稀释过程中,促进水的电离,即水的电离程度P>N,M点是CH3COONa溶液被稀释10倍时,CH3COO-发生水解,促进水的电离,而NaOH显强碱性,抑制溶液中水的电离,所以M点水的电离程度大于N点,则水的电离程度M>P>N,故D正确,
故选D。

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】用含FeCl2杂质的氯化铜晶体制纯净CuCl2·2H2O的过程是:先将晶体配制成水溶液,然后按如下图步骤进行提纯:
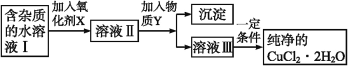
已知:在上述流程条件下,Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)加入氧化剂X的目的是_______。得到溶液II,最适合作氧化剂X的是______(选填以下编号)。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)为了除去Fe3+,需加入物质Y调节溶液的pH范围是_________________
(3)溶液Ⅲ得到CuCl2·2H2O晶体的操作是:蒸发浓缩,冷却结晶,____,___,干燥。
【题目】如图X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味气体放出,符合这一情况的是

a电极 | b电极 | X电极 | 电解质溶液 | |
A | Fe | 石墨 | 正极 | 稀硫酸 |
B | Zn | Cu | 负极 | CuSO4溶液 |
C | 石墨 | Pt | 负极 | AgNO3溶液 |
D | Pt | Cu | 正极 | CuCl2溶液 |
A. A B. B C. C D. D
【题目】常温下.有浓度均为0.1 mol·L-l的下列4种溶液:①NaCN溶液 ②NaOH溶液 ③CH3COONa溶液 ④NaHCO3溶液
HCN | H2CO3 | CH3COOH |
Ka=4.9×10-10 | Ka1=4×10-7 Ka2=5.6×10-11 | Ka=1.7×10-5 |
(1)这4种溶液pH由大到小的顺序是____________(填序号)。
(2)④的水解平衡常数Kh= _________。
(3)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③_____ ④(填“>”、“<"、“=”)
(4)向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:______________________。
【题目】造纸、炼焦、医药、塑料等行业的废水中常含有苯酚(C6H5OH),会对人类的生产和生活造成极大的危害。含酚废水的处理是环境科学领域的热点问题,下面介绍三项新技术。
电渗析
苯酚具有微弱的酸性,可利用电场促使C6H5O-定向移动、脱离废水,并富集回收。其电离方程式、电渗析装置示意图如下:


(1)为促进苯酚电离并增强溶液导电能力,可向废水中加入__________。
(2)A、B分别为离子交换膜,其中A应该是______(填“阳”或“阴”)离子交换膜。
催化重整制氢
在固定床反应器中,用含Rh催化剂使苯酚与水蒸气反应转化为氢气和二氧化碳。已知:2H2(g)+ O2(g)== 2H2O(g) ΔH1=-483.6 kJ·mol-1
C6H5OH(g)+ 7O2(g)== 6CO2(g)+ 3H2O(g) ΔH2=-2742.4 kJ·mol-1
(3)那么,反应C6H5OH(g)+ 11H2O(g)== 6CO2(g)+ 14H2(g) ΔH=_________kJ·mol-1。
活性炭纤维(ACF)物理吸附
ACF是一种活性炭纤维,不溶于水,具有多孔结构,可吸附苯酚等多种有机物质。下表是实验室里在不同温度下用0.50 g ACF吸附处理1 L苯酚溶液的相关数据。
T / ℃ | 25 | 35 | 45 | 55 | 65 |
起始苯酚浓度 / mol·L-1 | 1.50×10-3 | 1.50×10-3 | 1.50×10-3 | 1.50×10-3 | 1.50×10-3 |
平衡苯酚浓度 / mol·L-1 | 5.00×10-4 | 6.43×10-4 | 7.85×10-4 | 9.12×10-4 | 1.13×10-3 |
(4)由表格数据可知,C6H5OH(aq) + ACF(s) ![]() C6H5OH·ACF(s,吸附态) ΔH_____0(填“>”或“<”)。
C6H5OH·ACF(s,吸附态) ΔH_____0(填“>”或“<”)。
(span>5)已知:吸附平衡常数KF= ,(其中,平衡时单位质量吸附剂对苯酚的吸附量
,(其中,平衡时单位质量吸附剂对苯酚的吸附量![]() ;n为与ACF吸附能力相关的系数,25℃时n为0.5),计算25℃时KF(苯酚)=_____________________。
;n为与ACF吸附能力相关的系数,25℃时n为0.5),计算25℃时KF(苯酚)=_____________________。
