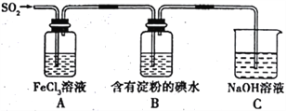
题目内容
【题目】用1.500mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示:
实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
1 | 25.00 | 24.41 |
2 | 25.00 | 24.39 |
3 | 25.00 | 25.90 |
回答下列问题:
(1)量取待测液时,使用25.00ml移液管或______滴定管;
(2)实验中,需要润洗的仪器是:____________________;
(3)取待测液NaOH溶液25.00ml 于锥形瓶中,使用酚酞做指示剂。滴定终点的判断依据是_____________________;
(4)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果__________(填“偏高”“偏低”“不变”,下同);若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果____________。
(5)未知浓度的NaOH溶液的物质的量浓度为__________ mol/L(保留小数点后3位有效数字)。
【答案】碱式 (酸、碱式)滴定管 当滴入最后一滴标准液,红色褪去,半分钟不再出现红色 偏高 偏低 1.464
【解析】
(1)碱式滴定管用来盛放碱性溶液,酸式滴定管用来盛放酸性、氧化性溶液;
(2)根据滴定管不用待盛装的溶液润洗,相当于给溶液稀释;盛装待测液的锥形瓶不能使用待测液润洗,否则待测液的物质的量偏大;
(3)用酚酞作指示剂时,滴定前,酚酞遇碱变红,到达滴定终点时观察到溶液颜色由红色变为无色;
(4)根据c(待测)=![]() 分析不当操作对V(标准)的影响,以此判断浓度的误差;判断数据的有效性,依据c(待测)=
分析不当操作对V(标准)的影响,以此判断浓度的误差;判断数据的有效性,依据c(待测)=![]() 计算氢氧化钠溶液的物质的量浓度。
计算氢氧化钠溶液的物质的量浓度。
(5)根据c(酸)V(酸)= c碱)V(碱)计算碱的浓度。
(1)待测液为氢氧化钠溶液,显碱性,应选择碱式滴定管量取;
(2)实验中,酸式滴定管、碱式滴定管需要用待盛装的溶液润洗,否则会被水稀释,锥形瓶则不能使用待测液润洗,否则待测液的物质的量偏大;
(3)碱溶液中滴加无色的酚酞,碱能使酚酞变红,故利用酚酞做指示剂,滴定达到终点的现象是酚酞的红色褪去且半分钟不再出现红色;
(4)若滴定前,滴定管尖端有气泡,滴定后气泡消失,导致消耗标准液体积偏大,依据c(待测)=![]() 可知,使所测结果偏高;若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,导致消耗标准液体积偏小,依据c(待测)=
可知,使所测结果偏高;若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,导致消耗标准液体积偏小,依据c(待测)=![]() 可知,使所测结果偏低;
可知,使所测结果偏低;
(5)三次实验消耗标准液体积分别为:24.41,24.39,25.90,舍弃第三次数据,则消耗标准液体积为:V(酸) =(24.41+24.39)÷2=24.40(mL),根据c(酸)V(酸)= c碱)V(碱),则待测液浓度为:c(待测)=![]() =1.464mol/L。
=1.464mol/L。

【题目】如图X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味气体放出,符合这一情况的是

a电极 | b电极 | X电极 | 电解质溶液 | |
A | Fe | 石墨 | 正极 | 稀硫酸 |
B | Zn | Cu | 负极 | CuSO4溶液 |
C | 石墨 | Pt | 负极 | AgNO3溶液 |
D | Pt | Cu | 正极 | CuCl2溶液 |
A. A B. B C. C D. D