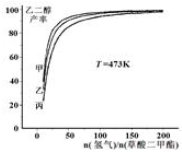
题目内容
18.2g (NH4)2SO4肥料跟浓碱液混合加热后,收集到标准状况下的NH3 600mL,计算该硫铵中氮的质量分数.分析 根据物质中某元素的质量分数=$\frac{该元素的质量}{该物质样品的质量}$×100%进行分析结合N元素守恒解答本题,2g (NH4)2SO4中氮的物质的量n(N)=n(NH3),根据m=nM计算氮元素的质量.
解答 解:标准状况下的NH3 600mL,n(NH3)=$\frac{V}{{V}_{m}}$=$\frac{0.6L}{22.4L/mol}$=$\frac{6}{224}$mol,n(N)=n(NH3),m(N)=nM=$\frac{6}{224}$mol×14g/mol=0.375g,2g (NH4)2SO4肥料中,氮元素的质量分数=$\frac{该元素的质量}{该物质样品的质量}$×100%=$\frac{0.375g}{2g}$×100%=18.75%,
答:该硫铵中氮的质量分数为18.75%.
点评 本题考查物质中某元素的质量分数的计算,依据元素的质量分数=$\frac{该元素的质量}{该物质样品的质量}$×100%结合N元素守恒即可解答,题目难度不大.

练习册系列答案
相关题目
9.在100mL水溶液中有5.85g NaCl和11.1g CaCl2,该溶液中c(Cl-)为( )
| A. | 1 mol•L-1 | B. | 2 mol•L-1 | C. | 3 mol•L-1 | D. | 4 mol•L-1 |
3.苯燃烧热的热化学方程式为C6H6(l)+$\frac{15}{2}$O2(g)=6CO2(g)+3H2O(l)△H=-3260kJ•mol-1,设阿伏伽德罗常数的值为NA,下列说法正确的是( )
| A. | 断裂3NA个碳碳双键时,放出3260kJ的热量 | |
| B. | 消耗336L O2时,放出6520kJ的热量 | |
| C. | 转移30NA个电子时,放出3260kJ的热量 | |
| D. | 生成3NA个气态水分子时,放出3260kJ的热量 |
4.甲酸广泛应用于制药和化工行业.某同学尝试用甲苯的氧化反应制备苯甲酸.反应原理:
 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$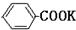 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
 +HCl→
+HCl→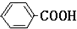 +KCl
+KCl
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.

已知:苯甲酸分子量是122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物一般都有固定熔点.
(1)操作Ⅰ为分液,操作Ⅱ为蒸馏.
(2)无色液体A是甲苯,定性检验A的试剂是酸性KMnO4溶液,现象是溶液褪色.
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔.该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容.
(4)纯度测定:称取1.220g产品,配成100ml甲醇溶液,移取25.00ml溶液,滴定,消耗KOH的物质的量为2.40×10-3mol.产品中甲苯酸质量分数的计算表达式为$\frac{2.4×1{0}^{-3}mol×4×122g/mol}{1.22g}$.
 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$ +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O +HCl→
+HCl→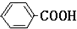 +KCl
+KCl实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.

已知:苯甲酸分子量是122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物一般都有固定熔点.
(1)操作Ⅰ为分液,操作Ⅱ为蒸馏.
(2)无色液体A是甲苯,定性检验A的试剂是酸性KMnO4溶液,现象是溶液褪色.
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔.该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,溶解 冷却、过滤, | 得到白色晶体和无色溶液 | -- |
| ② | 取少量滤液于试管中,滴入2-3滴AgNO3溶液 | 生成白色沉淀 | 滤液含有Cl- |
| ③ | 干燥白色晶体,加热使其融化,测其熔点 | 熔点为122.4℃ | 白色晶体是苯甲酸 |


 .
.