题目内容
13.如果25℃,Kw=10-14,100℃时,Kw=10-12.(1)25℃,0.1mol/L的盐酸中,c(H+)=0.1mol/L,由水电离出的c(H+)=10-13mol/L,c(OH-)=10-13mol/L;
(2)100℃时,0.1mol/L NaOH溶液中,c(OH-)=0.1mol/L,由水电离出的c(H+)=10-11mol/L,c(OH-)=10-11mol/L.
分析 (1)HCl是强电解质,故0.1mol/L的盐酸溶液中,c(H+)=0.1mol/L,根据水的离子积求出溶液中c(OH-),而溶液中的氢氧根全部来自于水的电离,且水电离出的c(H+)=c(OH-),据此分析计算;
(2)100℃时,Kw=10-12,NaOH溶液中,氢氧根基本全部来自于氢氧化钠本身,故可知0.1mol/L的氢氧化钠溶液中c(OH-),继而可求出溶液中的c(H+),而溶液中的氢离子全部来自于水,且水电离出的c(H+)=c(OH-),据此分析计算.
解答 解:(1)HCl是强电解质,故0.1mol/L的盐酸溶液中,c(H+)=0.1mol/L,根据水的离子积求出溶液中c(OH-)=$\frac{1{0}^{-14}}{0.1}$=10-13mol/L,而溶液中的氢氧根全部来自于水的电离,且水电离出的c(H+)=c(OH-)=10-13mol/L,故答案为:0.1mol/L;10-13mol/L;10-13mol/L;
(2)100℃时,Kw=10-12,NaOH溶液中,氢氧根基本全部来自于氢氧化钠本身,故可知0.1mol/L的氢氧化钠溶液中c(OH-)=0.1mol/L,故溶液中的c(H+)=$\frac{1{0}^{-12}}{0.1}$=10-11mol/L,而溶液中的氢离子全部来自于水,且水电离出的c(H+)=c(OH-)=10-11mol/L,
故答案为:0.1mol/L;10-11mol/L;10-11mol/L.
点评 本题考查酸碱溶液中pH的相关计算,注意100℃时Kw=10-12,明确由水电离出的c(H+)=c(OH-)是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
3.某混合气体由两种气态烃组.标准状况下,2.24L 该混合气体完全燃烧后,得到3.36L二氧化碳气体(标准状况)和3.6g水.下列说法中正确的是( )
| A. | 混合气体中一定含有甲烷 | B. | 混合气体一定是甲烷和乙烯 | ||
| C. | 混合气体中一定含有乙烷 | D. | 混合气体可能是甲烷和乙烯 |
19.肉桂酸是一种香料,具有很好的保香作用,通常作为配香原料,可使主香料的香气更加清香.实验室制备肉桂酸的化学方程式为:
 (苯甲醛)+(CH3CO)2O(乙酸酐)$→_{140-170℃}^{K_{2}CO_{3}}$
(苯甲醛)+(CH3CO)2O(乙酸酐)$→_{140-170℃}^{K_{2}CO_{3}}$ (肉桂酸)+CH3COOH(乙酸)
(肉桂酸)+CH3COOH(乙酸)
主要试剂及其物理性质
密度:常压,25℃测定
主要实验步骤和装置如下:

Ⅰ合成:按图1连接仪器,加入5mL苯甲醛、14mL乙酸酐和7.02g无水碳酸钾.在140~170℃,将此混合物回流45min.
Ⅱ分离与提纯:
①将上述合成的产品冷却后边搅拌边加入40ml水浸泡5分钟,并用水蒸气蒸馏,从混合物中除去未反应的苯甲醛,得到粗产品
②将上述粗产品冷却后加入40ml 10%的氢氧化钠水溶液,再加90ml水,加热活性炭脱色,趁热过滤、冷却;
③将1:1的盐酸在搅拌下加入到肉桂酸盐溶液中,至溶液呈酸性,经冷却、减压过滤、洗涤、干燥等操作得到较纯净的肉桂酸;
水蒸气蒸馏:使有机物可在较低的温度下从混合物中蒸馏出来,可以避免在常压下蒸馏时所造成的损失,提高分离提纯的效率.同时在操作和装置方面也较减压蒸馏简便一些,所以水蒸气蒸馏可以应用于分离和提纯有机物.回答下列问题:
(1)合成肉桂酸的实验需在无水条件下进行,实验前仪器必须干燥.实验中为控制温度在140~170℃需在BD中加热(请从下列选项中选择).
A.水 B.甘油(沸点290℃) C.砂子 D.植物油(沸点230~325℃)
反应刚开始时,会有乙酸酐(有毒)挥发,所以该实验应在通风橱或通风处中进行操作.
(2)图2中水蒸气蒸馏后产品在三颈烧瓶(填仪器名称)
(3)趁热过滤的目的防止肉桂酸钠结晶而析出堵塞漏斗,方法:用热过滤漏斗或采取保温措施.
(4)加入1:1的盐酸的目的是使肉桂酸盐转化为肉桂酸,析出的肉桂酸晶体通过减压过滤与母液分离.下列说法正确的是ACD.
A.选择减压过滤是因为过滤速度快而且能得到较干燥的晶体
B.放入比布氏漏斗内径小的滤纸后,直接用倾析法转移溶液和沉淀,再迅速开大水龙头抽滤
C.洗涤产物时,先关小水龙头,用冷水缓慢淋洗
D.抽滤完毕时,应先断开抽气泵和吸滤瓶之间的橡皮管,再关水龙头
(5)5mL苯甲醛、14mL乙酸酐和7.02g无水碳酸钾充分反应得到肉桂酸实际3.1g,则产率是41.9%(保留3位有效数字).
 (苯甲醛)+(CH3CO)2O(乙酸酐)$→_{140-170℃}^{K_{2}CO_{3}}$
(苯甲醛)+(CH3CO)2O(乙酸酐)$→_{140-170℃}^{K_{2}CO_{3}}$ (肉桂酸)+CH3COOH(乙酸)
(肉桂酸)+CH3COOH(乙酸)主要试剂及其物理性质
| 名称 | 分子量 | 性状 | 密度g/cm3 | 熔点℃ | 沸点℃ | 溶解度:克/100ml溶剂 | ||
| 水 | 醇 | 醚 | ||||||
| 苯甲醛 | 106 | 无色液体 | 1.06 | -26 | 178-179 | 0.3 | 互溶 | 互溶 |
| 乙酸酐 | 102 | 无色液体 | 1.082 | -73 | 138-140 | 12 | 溶 | 不溶 |
| 肉桂酸 | 148 | 无色结晶 | 1.248 | 133-134 | 300 | 0.04 | 24 | 溶 |
主要实验步骤和装置如下:

Ⅰ合成:按图1连接仪器,加入5mL苯甲醛、14mL乙酸酐和7.02g无水碳酸钾.在140~170℃,将此混合物回流45min.
Ⅱ分离与提纯:
①将上述合成的产品冷却后边搅拌边加入40ml水浸泡5分钟,并用水蒸气蒸馏,从混合物中除去未反应的苯甲醛,得到粗产品
②将上述粗产品冷却后加入40ml 10%的氢氧化钠水溶液,再加90ml水,加热活性炭脱色,趁热过滤、冷却;
③将1:1的盐酸在搅拌下加入到肉桂酸盐溶液中,至溶液呈酸性,经冷却、减压过滤、洗涤、干燥等操作得到较纯净的肉桂酸;
水蒸气蒸馏:使有机物可在较低的温度下从混合物中蒸馏出来,可以避免在常压下蒸馏时所造成的损失,提高分离提纯的效率.同时在操作和装置方面也较减压蒸馏简便一些,所以水蒸气蒸馏可以应用于分离和提纯有机物.回答下列问题:
(1)合成肉桂酸的实验需在无水条件下进行,实验前仪器必须干燥.实验中为控制温度在140~170℃需在BD中加热(请从下列选项中选择).
A.水 B.甘油(沸点290℃) C.砂子 D.植物油(沸点230~325℃)
反应刚开始时,会有乙酸酐(有毒)挥发,所以该实验应在通风橱或通风处中进行操作.
(2)图2中水蒸气蒸馏后产品在三颈烧瓶(填仪器名称)
(3)趁热过滤的目的防止肉桂酸钠结晶而析出堵塞漏斗,方法:用热过滤漏斗或采取保温措施.
(4)加入1:1的盐酸的目的是使肉桂酸盐转化为肉桂酸,析出的肉桂酸晶体通过减压过滤与母液分离.下列说法正确的是ACD.
A.选择减压过滤是因为过滤速度快而且能得到较干燥的晶体
B.放入比布氏漏斗内径小的滤纸后,直接用倾析法转移溶液和沉淀,再迅速开大水龙头抽滤
C.洗涤产物时,先关小水龙头,用冷水缓慢淋洗
D.抽滤完毕时,应先断开抽气泵和吸滤瓶之间的橡皮管,再关水龙头
(5)5mL苯甲醛、14mL乙酸酐和7.02g无水碳酸钾充分反应得到肉桂酸实际3.1g,则产率是41.9%(保留3位有效数字).
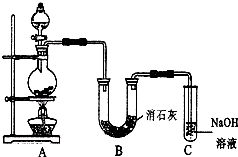 某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应).
某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应).