题目内容
9.在100mL水溶液中有5.85g NaCl和11.1g CaCl2,该溶液中c(Cl-)为( )| A. | 1 mol•L-1 | B. | 2 mol•L-1 | C. | 3 mol•L-1 | D. | 4 mol•L-1 |
分析 根据n=$\frac{m}{M}$计算5.85g NaCl和11.1g CaCl2的物质的量,根据氯元素守恒有n(Cl-)=n(NaCl)+2n( CaCl2),据此计算溶液中n(Cl-),再根据c=$\frac{n}{V}$计算溶液中Cl-的物质的量浓度.
解答 解:5.85g NaCl的物质的量为$\frac{5.85g}{58.5g/mol}$=0.1mol,11.1g CaCl2的物质的量为$\frac{11.1g}{111g/mol}$=0.1mol,根据氯元素守恒有n(Cl-)=n(NaCl)+2n( CaCl2)=0.1mol+0.1mol×2=0.3mol,所以溶液中Cl-的物质的量浓度为$\frac{0.3mol}{0.1L}$=3mol/L.
故选:C.
点评 本题考查物质的量浓度的有关计算,难度不大,注意理解物质的量浓度定义,根据化学式判断氯离子与氯化钠、氯化镁的关系是关键.

练习册系列答案
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
19.按照物质的树状分类和交叉分类,硫酸应属于( )
①酸 ②能导电 ③含氧酸 ④混合物 ⑤化合物 ⑥二元酸 ⑦强电解质.
①酸 ②能导电 ③含氧酸 ④混合物 ⑤化合物 ⑥二元酸 ⑦强电解质.
| A. | ①②③④⑦ | B. | ①③⑤⑥⑦ | C. | ①③④⑥⑦ | D. | ②③⑤⑥⑦ |
20.下列化学反应一定属于放热反应的是( )
| A. | Ba(OH)2•8H2O与NH4C1反应 | B. | 水解反应 | ||
| C. | 醋酸的电离 | D. | 盐酸与NaOH溶液的反应 |
14.下列反应的离子方程式正确的是( )
| A. | 澄清的石灰水跟稀硝酸反应:Ca(OH)2+2H+=Ca2++2H2O | |
| B. | 氢氧化钡溶液和硫酸铜溶液反应:Ba2++SO42-=BaSO4↓ | |
| C. | 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O | |
| D. | 往澄清石灰水中通入少量二氧化碳气体:CO2+OH-=HCO3- |
15.实验室里用加热正丁醇、溴化钠和浓硫酸的混合物的方法来制备1-溴丁烷,已知有关物质的性质如下:

(1)生成1-溴丁烷的化学方程式为CH3CH2CH2CH2OH+NaBr+H2SO4$\stackrel{△}{→}$CH3CH2CH2CH2Br+NaHSO4+H2O.
(2)由于副反应的发生而可能产生的副产物有CH3CH2CH=CH2、CH3CH2CH2CH2OCH2CH2CH2CH3.(至少两种,有机物用结构简式表示)
(3)为了将反应混合物中1-溴丁烷及时分离出,应选用的装置是D(填序号),该操作应控制的温度t2范围是101.6℃≤t<117.25℃.
(4)在得到的1-溴丁烷的产物中出现了分层现象,某同学选择用分液的方法进行分离.在本实验分离过程中,产物应该从分液漏斗的下口放出(填“上口倒出”或“下口放出”).
(5)本实验所用的正丁醇质量为20.0g,最后得到纯净的1-溴丁烷的质量为22.2g,本实验的产率约是C(填正确答案标号).
A.40% B.50% C.60% D.70%
| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | |
| 正丁醇 | -89.53 | 117.25 | 0.81 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.28 |

(1)生成1-溴丁烷的化学方程式为CH3CH2CH2CH2OH+NaBr+H2SO4$\stackrel{△}{→}$CH3CH2CH2CH2Br+NaHSO4+H2O.
(2)由于副反应的发生而可能产生的副产物有CH3CH2CH=CH2、CH3CH2CH2CH2OCH2CH2CH2CH3.(至少两种,有机物用结构简式表示)
(3)为了将反应混合物中1-溴丁烷及时分离出,应选用的装置是D(填序号),该操作应控制的温度t2范围是101.6℃≤t<117.25℃.
(4)在得到的1-溴丁烷的产物中出现了分层现象,某同学选择用分液的方法进行分离.在本实验分离过程中,产物应该从分液漏斗的下口放出(填“上口倒出”或“下口放出”).
(5)本实验所用的正丁醇质量为20.0g,最后得到纯净的1-溴丁烷的质量为22.2g,本实验的产率约是C(填正确答案标号).
A.40% B.50% C.60% D.70%
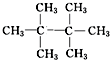
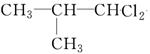 、
、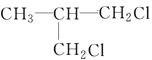 、
、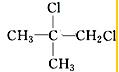 .
.