题目内容
【题目】A、B、C、X是中学化学中常见的物质。在一定条件下,它们之间的转化关系如下图所示(部分产物已略去)。
![]()
回答下列问题:
(1)若X是空气的主要成分之一,则A不可能是_____(填代号)。
a.Na b.C c.S d.Al
(2)若A常用作制冷剂,C为红棕色气体。写出由A生成B的化学方程式___________。
(3)若C可用于治疗胃酸过多,X是一种常见的温室气体。
①鉴别等浓度的B溶液和C溶液,可选用的试剂为______________(填化学式)。
②将A、B、C三种溶液混合,向45mL混合液中逐滴加入一定浓度的盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系如下图所示。
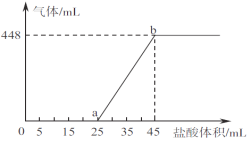
写出ab段所发生反应的离子方程式__________________________;b点对应溶液中溶质的物质的量浓度为___________(忽路溶液体积变化)。
【答案】d4NH3+5O2![]() 4NO+6H2OHCl或H2SO4或HNO3或BaCl2或CaCl2HCO3-+H+=H2O+CO2↑0.5 mol·L-1
4NO+6H2OHCl或H2SO4或HNO3或BaCl2或CaCl2HCO3-+H+=H2O+CO2↑0.5 mol·L-1
【解析】
由反应的转化关系可以知道A可与X连续反应,如A为金属,应为变价金属,如X为氧气,则A可为变价非金属或Na,图中转化关系可符合铝三角的转化,或为多元弱酸对应的盐,
详解: (1)若X是O2,则A不可能是Al,故答案选:d;
(2) 若A常用作制冷剂,C为红棕色气体,则A为NH3,B为NO,C为NO2,X为O2,所以由A生成B的化学方程式:4NH3+5O2![]() 4NO+6H2O,
4NO+6H2O,
因此,本题正确答案是:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(3) 若C可用于治疗胃酸过多,X是一种常见的温室气体,则X为CO2,A为NaOH,B为Na2CO3, C为NaHCO3,
①鉴别等浓度的Na2CO3溶液和NaHCO3溶液,可选用的试剂为HCl或H2SO4或HNO3或BaCl2或CaCl2
因此,本题正确答案是:HCl或H2SO4或HNO3或BaCl2或CaCl2;
②假设混合后的溶液中只有Na2CO3,向混合溶液中滴加盐酸,开始发生反应:Na2CO3+HCl= NaHCO3+NaCl,然后发生反应:NaHCO3+HCl= NaCl+H2O+CO2↑,前后2阶段消耗盐酸的体积相等,而实际中生成二氧化碳消耗盐酸较少,说明Oa段发生:NaOH+HCl=NaCl+H2O,Na2CO3+HCl= NaHCO3+NaCl,而ab段发生:NaHCO3+HCl= NaCl+H2O+CO2↑,则: ab段所发生反应的离子方程式HCO3-+H+=H2O+CO2↑,
因此,本题正确答案是为:HCO3-+H+=H2O+CO2↑;
ab段发生:NaHCO3+HCl= NaCl+H2O+CO2↑,所以二氧化碳的物质的量就是的盐酸的物质的量,根据c=![]() =1mol/L,
=1mol/L,
b点对应溶液中溶质为NaCl,根据氯元素守恒,NaCl的物质的量等于加入的HCl的物质的量,n=1mol/L×0.045L=0.045mol,所以NaCl的物质的量浓度为:![]() 0.5mol/L,
0.5mol/L,
因此,本题正确答案是:0.5 mol·L-1。