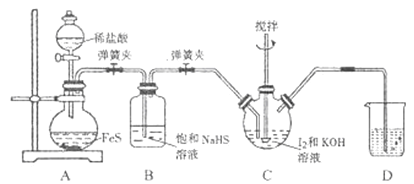
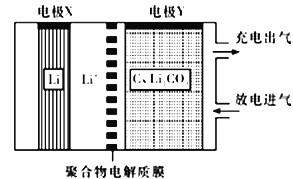
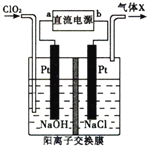
题目内容
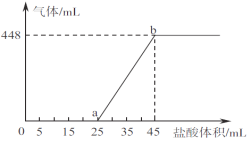
【题目】一定温度下,在容积为2 L的密团容器中进行某一反应,容器内M、N两种气体的物质的量随时间的变化曲线如图所示。据图可知

A. 该反应的化学方程式为N(g) ![]() 2M(g) B. t1~t2时间内,v(M)=(1/t2-t1) mol·L-1·min-1
2M(g) B. t1~t2时间内,v(M)=(1/t2-t1) mol·L-1·min-1
C. t2时,正逆反应速率相等,反应达平衡状态 D. 平衡时,物质N的转化率为75%
【答案】D
【解析】分析:A、根据图象判断出反应物和生成物,根据物质的量的变化判断计量数之间的关系;
B、根据v=![]() 来计算;
来计算;
C、根据t2时反应中各物质的物质的量是否变化判断反应是否达到平衡;
D、根据转化率=转化量/起始量×100%来计算。
详解:A、由图象可以知道,反应中M的物质的量逐渐增多,N的物质的量逐渐减少,则在反应中N为反应物,M为生成物,图象中,在相等的时间内消耗的N和M的物质的之比为2:1,所以反应方程式应为:2N![]() M,故A错误;
M,故A错误;
B、由图可以知道,t1~t2时间内,v(M)=![]() mol·L-1·min-1=
mol·L-1·min-1=![]() mol·L-1·min-1,故B错误;
mol·L-1·min-1,故B错误;
C、由图可以知道t2时,M和N的浓度相等,正逆反应速率并不相等,所以反应没有达平衡状态故C错误;
D、由图可以知道,起始时N的物质的量为8mol,平衡时N的物质的量为2mol,则N的转化率为![]() 100%=75%,故D正确。
100%=75%,故D正确。
所以D选项是正确的。

练习册系列答案
相关题目
【题目】除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的的是:
混合物 | 试剂 | 分离方法 | |
A | 苯(甲苯) | 溴水 | 分液 |
B | 乙烷(乙烯) | 氢气 | 加热 |
C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
D | 淀粉(氯化钠) | 蒸馏水 | 渗析 |
A. A B. B C. C D. D