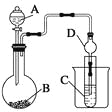
题目内容
【题目】现有A、B、C、D、E、F、G七种元素,其中 A、B、C、D、E、F为短周期元素且原子序数依次增大;A的最高正价与最低负代数和为零;B的最高价氧化物与C的氢化物在水中反应得到的生成物X既可与酸反应又可与碱反应;常温下D2是气体,标况时D2气体的密度约是1.43g/L;E原子半径在同周期中除稀有气体外最大, F原子M层上的电子比K层多5个。金属G的合金在生活中用量最大,用途最广。
(1)G在元素周期表中的位置是_________,画出F的离子结构示意图____________
(2)D、E、F离子半径由大到小顺序为:___________________(用离子符号表示)
(3)A与D可形成原子个数比为1:1的化合物,用电子式表示该化合物的形成过程_________________________
(4)D与E形成某离子化合物H具有漂白性,写出H的电子式_______________,该化合物和B与D形成的某化合物反应的化学方程式为:_______________,1molH发生该反应转移电子数为_____________
(5)若X为正盐,X中含有的化学键类型为_______________,写出加热该盐的化学方程式:_______________
(6)B和F两种元素相比较,原子得电子能力较强的为_______________,以下三种说法中,可以验证B和F得电子能力强弱的是_______________(填写编号);
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,F元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(7)金属元素G可与F形成化合物GF3。将G的单质与石墨用导线相连浸入GF3溶液中形成一个原电池。该原电池工作时,石墨一极发生的反应可以表示为___________,当有1.2mol e-转移时单质G质量变化为___________g
(8)用A元素的单质与D元素的常见单质可以制成电池,电池中装有KOH浓溶液,用多孔的惰性电极甲和乙浸入KOH溶液,在甲极通入A的单质,乙极通入D的单质,则甲极的电极反应式为:___________________。
【答案】(1)第四周期,第Ⅷ族;![]()
(2)Cl->O2->Na+
(3)![]()
(4)![]() ;2Na2O2+2CO2=2Na2CO3+O2(1分)6.02*1023
;2Na2O2+2CO2=2Na2CO3+O2(1分)6.02*1023
(5)离子键、共价键(NH4)2CO3 ![]() 2NH3↑+H2O+CO2↑
2NH3↑+H2O+CO2↑
(6)Cl(1分)bc(1分)
(7)2Fe3++2e-= 2Fe2+ ;33.6
(8)H2– 2e-+ 2OH-=" 2" H2O
【解析】试题分析:A、B、C、D、E、F为短周期元素且原子序数依次增大,常温下D2是气体,标况时D2气体的密度约是1.43g/L,则其相对分子质量为1.43×22.4=32,则D为O元素;A的最高正价与最低负代数和为零,则A处于ⅠA族或ⅣA族,原子序数比氧的至少小3,故A为氢元素;B的最高价氧化物与C的氢化物在水中反应得到的生成物X既可与酸反应又可与碱反应,B、C原子序数都小于氧,故X为碳酸的铵盐,可能为正盐碳酸铵或酸式盐碳酸氢铵,则B为碳元素、C为N元素;E原子半径在同周期中除稀有气体外最大,处于IA族,原子序数大于氧,则E为Na;F原子M层上的电子比K层多5个,最外层电子数为7,故F为Cl元素;G的合金在生活中用量最大,用途最广,该合金为钢,则G为Fe元素。
(1)G为Fe,在元素周期表中的位置是:第四周期第Ⅷ族,F为Cl,离子结构示意图为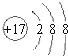 ,故答案为:第四周期第Ⅷ族;
,故答案为:第四周期第Ⅷ族;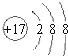 ;
;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故D、E、F离子半径由大到小顺序为:Cl->O2->Na+,故答案为:Cl->O2->Na+;
(3)A与D可形成原子个数比为1:1的化合物为H2O2,用电子式表示该化合物的形成过程:![]() ,故答案为:
,故答案为:![]() ;
;
(4)D与E形成某离子化合物H具有漂白性,则H为Na2O2,电子式为![]() ,该化合物和B与D形成的某化合物反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,1mol过氧化钠发生该反应生成0.5mol氧气,转移1mol电子,故转移电子数为6.02×1023 ,故答案为:
,该化合物和B与D形成的某化合物反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,1mol过氧化钠发生该反应生成0.5mol氧气,转移1mol电子,故转移电子数为6.02×1023 ,故答案为:![]() ;2Na2O2+2CO2=2Na2CO3+O2;6.02×1023 ;
;2Na2O2+2CO2=2Na2CO3+O2;6.02×1023 ;
(5)X为正盐,则X为碳酸铵,含有离子键、共价键,碳酸铵加热分解生成氨气、二氧化碳气体和水,反应的化学方程式为:(NH4)2CO3![]() 2NH3↑+H2O+CO2↑,故答案为:离子键、共价键; (NH4)2CO3
2NH3↑+H2O+CO2↑,故答案为:离子键、共价键; (NH4)2CO3![]() 2NH3↑+H2O+CO2↑;
2NH3↑+H2O+CO2↑;
(6)碳和氯两种元素相比较,原子得电子能力较强的为氯,a.单质的沸点属于物理性质,不能比较得电子能力强弱,故a错误;b.二者形成的化合物中,F(氯)元素的原子显负价,说明氯元素对键合电子吸引更强,则Cl原子得电子能力更强,故b正确;c.非金属性与氢化物稳定性一致,非金属性越强,得电子能力越强,故c正确,故答案为:Cl;bc;
(7)金属元素G可与F形成化合物FeCl3.将Fe的单质与石墨用导线相连浸入FeCl3溶液中形成一个原电池,该原电池工作时,石墨为正极,发生还原反应,电极反应式为:2Fe3++2e-═2Fe2+,根据电子转移守恒,当有1.2mol e-转移时,参加反应的Fe为![]() =0.6mol,故单质Fe质量变化为0.6mol×56g/mol=33.6g故答案为:2Fe3++2e-═2Fe2+;33.6;
=0.6mol,故单质Fe质量变化为0.6mol×56g/mol=33.6g故答案为:2Fe3++2e-═2Fe2+;33.6;
(8)氢气、氧气制成电池,电池中装有KOH浓溶液,氢气发生氧化反应、氧气发生还原反应,在甲极通入氢气,乙极通入氧气,则甲为负极,乙为正极,甲极上是氢气失去电子,碱性条件下生成水,电极反应式为:H2-2e-+2OH-="2" H2O,故答案为:H2-2e-+2OH-="2" H2O。

 名校课堂系列答案
名校课堂系列答案【题目】丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈(CH3CN)等,回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①C3H6(g)+NH3(g)+ 3/2O2(g)=C3H3N(g)+3H2O(g) ΔH=-515kJ/mol
①C3H6(g)+ O2(g)=C3H4O(g)+H2O(g) ΔH=-353kJ/mol
两个反应在热力学上趋势均很大,其原因是________;有利于提高丙烯腈平衡产率的反应条件是________;提高丙烯腈反应选择性的关键因素是________。
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应温度为460℃。低于460℃时,丙烯腈的产率________(填“是”或者“不是”)对应温度下的平衡产率,判断理由是________;高于460℃时,丙烯腈产率降低的可能原因是________(双选,填标号)
A.催化剂活性降低 | B.平衡常数变大 | C.副反应增多 | D.反应活化能增大 |
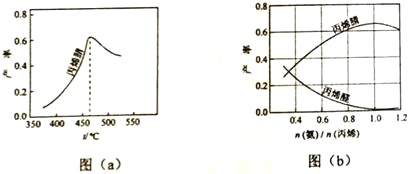
(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为,理由是_______________。进料氨、空气、丙烯的理论体积约为________。