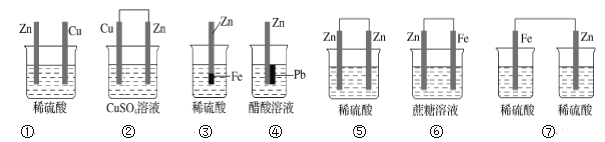
题目内容
【题目】现有下列物质:
①稀硫酸 ②小苏打 ③氨水 ④二氧化碳 ⑤FeCl3固体 ⑥稀NaOH溶液 ⑦硝酸亚铁溶液
(1)上述物质中属于电解质的物质序号为______ 。
(2)加入盐酸、NaOH溶液均能发生化学反应的物质序号为______。
(3)写出小苏打与胃酸(主要成分为稀盐酸)作用的离子方程式:___________
(4)实验室用⑤制备胶体的化学方程式为_____________________________。如果将1molFeCl3全部制成胶体,制得的胶体________(选填“带负电”“电中性”“带正电”),胶粒数目________NA(选填“大于”“等于”“小于”)
【答案】②⑤ ②⑦ HCO3- + H+ = CO2 ↑+ H2O FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl 电中性 小于
Fe(OH)3(胶体)+3HCl 电中性 小于
【解析】
应用电解质的概念、胶体的概念与性质等分析判断。
(1)电解质是溶解于水或熔化时能导电的化合物,①稀硫酸、③氨水、⑥稀NaOH溶液、⑦硝酸亚铁溶液,都是混合物,不是电解质;④二氧化碳的水溶液能导电,但自身不能电离,属于非电解质;
只有②小苏打、⑤FeCl3固体属于电解质。
(2)①稀硫酸、④二氧化碳、⑤FeCl3固体,能与NaOH溶液反应、不能与盐酸反应;③氨水、⑥稀NaOH溶液能与盐酸反应、不能与NaOH溶液反应;②小苏打、⑦硝酸亚铁溶液与盐酸、NaOH溶液均能发生化学反应,反应的离子方程式为
HCO3- + H+ = CO2 ↑+ H2O,HCO3- + OH-= CO32-+ H2O;
Fe2++2OH-=Fe(OH)2↓,3Fe2++NO3-+4H+=3Fe3++NO↑+ 2H2O。
(3)小苏打与胃酸(主要成分为稀盐酸)反应的离子方程式HCO3- + H+ ==CO2 ↑+ H2O。
(4)实验室将饱和FeCl3溶液滴入沸水中制备氢氧化铁胶体,化学方程式为FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl。胶体是分散质粒子直径在1nm~100nm之间的分散系,故胶体为电中性。每个氢氧化铁胶体粒子含有很多数目不等的Fe(OH)3,故1molFeCl3全部制成胶体,制得的胶粒数目小于NA。
Fe(OH)3(胶体)+3HCl。胶体是分散质粒子直径在1nm~100nm之间的分散系,故胶体为电中性。每个氢氧化铁胶体粒子含有很多数目不等的Fe(OH)3,故1molFeCl3全部制成胶体,制得的胶粒数目小于NA。

【题目】已知2A(g)+B(g)![]() 2C(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后,C的浓度为ω mol·L-1,放出的热量为b kJ。
2C(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后,C的浓度为ω mol·L-1,放出的热量为b kJ。
(1)已知:A(g)+X(g)![]() 2B(g) ΔH=-133.2 kJ·mol-1;
2B(g) ΔH=-133.2 kJ·mol-1;
5A(g)+X(g)![]() 4C(g) ΔH=-650.4 kJ·mol-1。则a=________。
4C(g) ΔH=-650.4 kJ·mol-1。则a=________。
(2)不同温度下该反应的平衡常数如表所示。由此可推知,表中T1________T2(填“>”“=”或“<”)。
T/K | T1 | T2 | T3 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
若在原来的容器中,只加入2 mol C,500 ℃时充分反应达平衡后,吸收热量为c kJ,C的浓度________________ω mol·L-1(填“>”“=”或“<”),a、b、c之间的关系为________________。
(3)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是________(填序号)。
A.4 mol A和2 mol B
B.4 mol A、2 mol B和2 mol C
C.4 mol A和4 mol B
D.6 mol A和4 mol B
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol A和1 mol B,500 ℃时充分反应达平衡后,放出的热量为d kJ,则d________b(填“>”“=”或“<”),理由是____________________________________。
(5)在一定温度下,向一个容积可变的容器中,通入3 mol A和2 mol B及固体催化剂,充分反应,平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol A、3 mol B和2 mol C,则平衡时A的百分含量________(填“不变”“变大”“变小”或“无法确定”)。