题目内容
在一个密闭容器中,中间有一可自由滑动的隔板,将容器分成两部分。当左边充入1molN2,右边充入8gCO和CO2的混合气体时,隔板处于如右图所示位置(两侧温度相同)。则混合气体中CO和CO2的分子个数比为 ( )
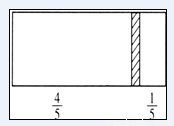
A.1:1 B.1:3 C.2:1 D.3:1
D
【解析】
试题分析:左右两侧气体温度、压强相同,相同条件下,体积之比等于物质的量之比,令8gCO和CO2的混合气体的物质的量为n,则:1mol:n= ,解得,n=0.25mol。所以CO和CO2的混合气体的平均相对分子质量是8÷0.25=32,利用十字交叉法计算CO和CO2的物质的量之比
,解得,n=0.25mol。所以CO和CO2的混合气体的平均相对分子质量是8÷0.25=32,利用十字交叉法计算CO和CO2的物质的量之比 ,所以CO和CO2的物质的量之比为12:4=3:1,分子数之比等于物质的量之比,所以CO和CO2的分子数之比为3:1,答案选D。
,所以CO和CO2的物质的量之比为12:4=3:1,分子数之比等于物质的量之比,所以CO和CO2的分子数之比为3:1,答案选D。
考点:考查阿伏伽德罗定律及推论计算、混合物的有关计算
点评:该题是中等难度的试题,判断CO和CO2混合气体的物质的量是解题关键。本题采取十字交叉法计算CO和CO2的物质的量之比,也可利用常规解法结合质量、物质的量计算CO和CO2的物质的量。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案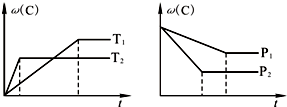
| A、T1<T2,该可逆反应的正反应为放热反应 | B、P1<P2,A为非气态物质 | C、达到平衡时,再加入少量反应物A,可使反应物B的转化率增大 | D、恒容条件下混合气体的密度保持不变时反应一定达到平衡 |
丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。已知:
①2C3H8(g) +7O2(g) = 6CO(g)+8H2O(g)?? △H = -2389.8 kJ/mol
②2CO(g) + O2(g) = 2CO2(g)????????????? △H = -566 kJ/mol
③H2O(l) = H2O(g)???? △H = + 44.0 kJ/mol
(1)写出C3H8燃烧时燃烧热的热化学方程式???????????????????????????????????????????? 。
(2)C3H8在不足量的氧气里燃烧,生成CO、CO2、H2O(g),将所有的产物通入一个体积固定的密闭
容器中,在一定条件下发生如下可逆反应: CO(g) +? H2O(g) CO2(g) +? H2(g)
CO2(g) +? H2(g)
该反应的平衡常数与温度的关系如下表:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
保持温度为800℃,在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,充分反应直至达到平衡。
| H2O | CO | CO2 | H2 |
甲 (质量/g) | 1.8 | 8.4 | a | 1 |
乙 (质量/g) | 1.8 | 2.8 | 0 | 0 |
①起始时,要使甲容器中反应向正反应方向进行,则a的取值范围是????????????????? ;达到平衡
时,乙容器中CO的转化率为???????? 。
②如图表示上述甲容器中反应在t1时刻达到平衡,在t2时刻因改变某一个条件而发生变化的情况。则t2时刻改变的条件可能是???????????????????????????? 、??????????????????? (答两个要点即可)。

(3)CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3。
① Na2CO3溶液中离子浓度由大到小的顺序为 ?????????? ??? ;
② 已知25℃时,H2CO3的电离平衡常数K1 = 4.4×10-7 mol/L、K2 = 4.7×10-11 mol/L,当Na2CO3溶液的pH为11时, 溶液中c(HCO3-)∶c(CO32-) = ?????????? 。
③ 0.1 mol/L Na2CO3溶液中c(OH-) - c(H+ ) = ?????????????????????? [用含c(HCO3-)、c(H2CO3)的符号表示]。
 2NH3。
2NH3。