题目内容
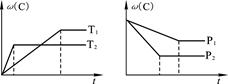
在一个密闭容器中有可逆反应:A+2B(g)?3C(g),该反应在不同条件下的生成物C的百分含量ω(C)与反应时间t有如图所示关系.根据上述图象判断下列说法错误的是( )
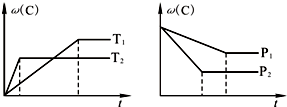

| A、T1<T2,该可逆反应的正反应为放热反应 | B、P1<P2,A为非气态物质 | C、达到平衡时,再加入少量反应物A,可使反应物B的转化率增大 | D、恒容条件下混合气体的密度保持不变时反应一定达到平衡 |
分析:根据“先拐先平数值大”,即曲线先折拐的首先达到平衡,由左图知,温度T2为先到达平衡,故T2>T1,升高温度C的百分含量减小,则平衡向逆反应方向移动,故正反应为放热反应;由右图可知,压强为P2先到达平衡,故P2>P1,增大压强C的百分含量减小,则平衡向逆反应移动,故A为非气态,据此解答.
解答:解:A.温度T2为先到达平衡,故T2>T1,升高温度C的百分含量减小,则平衡向逆反应方向移动,故正反应为放热反应,故A正确;
B.强为P2先到达平衡,故P2>P1,增大压强C的百分含量减小,则平衡向逆反应移动,故A为非气态,故B正确;
C.A为非气态物质,增大A的量不影响平衡移动,不能增大B的转化率,故C错误;
D.由于A为非气态物质,随反应进行混合气体的总质量发生比例,即密度发生不变,当密度不发生变化时说明到达平衡,故D正确,
故选C.
B.强为P2先到达平衡,故P2>P1,增大压强C的百分含量减小,则平衡向逆反应移动,故A为非气态,故B正确;
C.A为非气态物质,增大A的量不影响平衡移动,不能增大B的转化率,故C错误;
D.由于A为非气态物质,随反应进行混合气体的总质量发生比例,即密度发生不变,当密度不发生变化时说明到达平衡,故D正确,
故选C.
点评:本题考查化学平衡影响因素、化学平衡图象等,难度中等,根据“先拐先平数值大”判断温度或压强的高低,再依据外界条件对平衡的影响确定答案.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
 在一个密闭容器中,中间有一可自由滑动的隔板,将容器分成两部分.当左边充入28gN2,右边充入8gCO和CO2的混合气体时,隔板处于如图所示位置(两侧温度相同).则混合气体中CO和CO2的分子个数比为( )
在一个密闭容器中,中间有一可自由滑动的隔板,将容器分成两部分.当左边充入28gN2,右边充入8gCO和CO2的混合气体时,隔板处于如图所示位置(两侧温度相同).则混合气体中CO和CO2的分子个数比为( ) 3C(g),该反应在不同条件下的生成物C的百分含量ω(C)与反应时间t有如图所示关系。根据上述图象判断下列说法错误的是
3C(g),该反应在不同条件下的生成物C的百分含量ω(C)与反应时间t有如图所示关系。根据上述图象判断下列说法错误的是 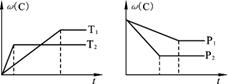

 3C(g),该反应在不同条件下的生成物C的百分含量ω(C)与反应时间t有如图所示关系。根据上述图象判断下列说法错误的是
3C(g),该反应在不同条件下的生成物C的百分含量ω(C)与反应时间t有如图所示关系。根据上述图象判断下列说法错误的是