题目内容
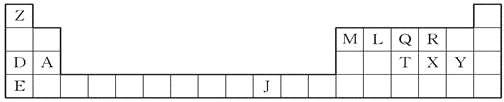
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
(1)T、X、Y原子的第一电离能由小到大的顺序是____________(用元素符号表示)。
(2)LX2分子的电子式是________________,XY2分子是____________(填“极性分子”或“非极性分子”);QY3分子中Q采用________杂化。
(3)由J、L、R三种元素形成的某种配位化合物,该化合物具有挥发性,化学式J(LR)4,其中J的化合价是0价。则基态J原子的核外电子排布式是___________________________;写出与配位体微粒互为等电子体的离子、分子各一种________、________。
(4)由Z、L、Q三种元素组成的化合物,分子式为Z9L3Q,它有_________种同分异构体(其中Q以三个单键与其他原子相连),请写出其中沸点最低的物质的结构简式__________________。
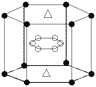
(5)A与M组成的一种化合物AM2,刷新了金属化合物超导温度的最高纪录。右图所示的是该化合物的晶体结构单元。图中上下底面中心“△”处的原子是________(填元素符号)。
【答案】(1)S<P<Cl (1分)(2)![]() 极性分子 sp3 (各1分)
极性分子 sp3 (各1分)
(3)1s22s22p63s23p63d84s2或[Ar]3d84s2CN-N2 (各1分)
(4) 4 N(CH3)3(2分) (5)Mg ( 2分)
【解析】试题分析:根据元素在周期表中的位置可判断A是Mg,D是Na,E是K,Z是H,M是B,L是C,Q是N,R 是O,T是P,X是S,Y是Cl,J是Ni。
(1)非金属性越强,第一电离能越大,但P元素的3p轨道电子处于半充满状态,稳定性强,第一电离能大于相邻元素,则T、X、Y原子的第一电离能由小到大的顺序是S<P<Cl。
(2)LX2分子是CS2,其结构与CO2类似,电子式![]() ,XY2分子SCl2,中心原子含有的价层电子对数是
,XY2分子SCl2,中心原子含有的价层电子对数是![]() ,含有2对孤对电子,其结构是V形,因此是极性分子;QY3分子是NCl3,中心原子含有的价层电子对数是
,含有2对孤对电子,其结构是V形,因此是极性分子;QY3分子是NCl3,中心原子含有的价层电子对数是![]() ,含有1对孤对电子,中Q采用sp3 杂化。
,含有1对孤对电子,中Q采用sp3 杂化。
(3)由J、L、R三种元素形成的某种配位化合物,该化合物具有挥发性,化学式Ni(CO)4,其中Ni的化合价是0价,原子序数是28,则根据核外电子排布规律可知基态J原子的核外电子排布式是1s22s22p63s23p63d84s2或[Ar]3d84s2;原子数和价电子数分别都相等的是等电子体,则与CO互为等电子体的离子、分子分别是CN-、N2。
(4)由Z、L、Q三种元素组成的化合物,分子式为Z9L3Q,结构简式有CH3CH2CH2NH2,CH3CH(NH2)CH3,HN(CH3)2,N(CH3)3,有4种同分异构体,其中支链越多,沸点越低,因此沸点最低的物质的结构简式为N(CH3)3。
(5)A与M组成的一种化合物MgB2,根据晶胞结构可知顶点处的原子共计有12×1/6=2,位于面上的原子共计是2×1/2=1,所以图中上下底面中心“△”处的原子是Mg。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案