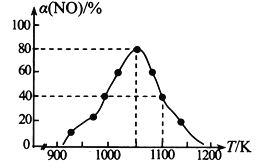
题目内容
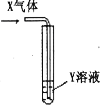
【题目】欲测定金属镁的相对原子质量,请利用下图给定的仪器组成一套实验装置(每个仪器只能使用一次,假设气体的体积可看作标准状况下的体积)。

填写下列各项(气流从左到右):
(1)各种仪器连接的先后顺序是__________接________、________接________、________接________、________接________(用小写字母表示)。
(2)连接好仪器后,要进行的操作有以下几步,其先后顺序是________________(填序号)。
①待仪器B中的温度恢复至室温时,测得量筒C中水的体积为Va mL;
②擦掉镁条表面的氧化膜,将其置于天平上称量,得质量为m g,并将其投入试管B中的带孔隔板上;
③检查装置的气密性;
④旋开装置A上分液漏斗的活塞,使其水顺利流下,当镁完全溶解时再关闭这个活塞,这时A中共放入水Vb mL。
(3)根据实验数据可算出金属镁的相对原子质量,其数学表达式为___________________。
(4)若试管B的温度未冷却至室温,就读出量筒C中水的体积,这将会使所测定镁的相对原子质量数据________(填“偏大”“偏小”或“无影响”)。
(5)仔细分析上述实验装置后,经讨论认为结果会有误差,于是又设计了如下图所示的实验装置。

①装置中导管a的作用是_________________________________________。
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为____________mL。
【答案】ahgbcfed ③②④① 22.4×1000m/(Va-Vb) 偏小 使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下;可以消除由于加入稀硫酸引起的氢气体积误差 V1-V2
【解析】
本题测定镁的相对分子质量的方法是通过镁与盐酸反应测定生成的氢气的体积,再根据化学方程式计算出镁的相对分子质量。要明确每个装置的作用,A装置起增压作用,在B装置中镁和盐酸进行反应,C装置测量水的体积,也就是生成的氢气排出水的体积,D装置是把生成氢气的体积转化成水的体积,E中盛放的是反应物盐酸。根据实验原理和各装置的作用,我们可以按步骤连接装置。为了使实验结果准确,测量的氢气的体积和所用的镁条的质量都要准确,据此解答。
(1)气流从左到右,各仪器连接顺序为a、h、g、b、c、f、e、d,注意要想排出洗气瓶中的液体时,气体要从短导管进入,液体从长导管排出;故答案为:a;h;g;b;c;f;e;d。
(2)连接好仪器后,要先检查装置气密性,再放入药品,然后收集气体,所以先后顺序为③②④①;故答案为:③②④①。
(3)通过(2)可知氢气的体积V=Va-Vb,则氢气的质量m=![]() ,根据方程式可知
,根据方程式可知
Mg+2HCl=MgCl2+H2↑
Mg 2g
mg ![]()
所以镁的相对原子质量M=![]() ;故答案为:
;故答案为:![]() 。
。
(4)若试管B的温度未冷却至室温,就读出量筒C中水的体积,C中水的体积要比实际体积大,使氢气的测得值比实际值大,从而使测定镁的相对原子质量偏小,故答案为:偏小。
(5)①由于气体体积受温度影响大,所以装置中导管a的作用是:保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除因为加入稀硫酸引起的氢气体积误差,故答案为:使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下;可以消除由于加入稀硫酸引起的氢气体积误差。
②滴定管的数值零刻度在上方,两次的体积之差为测定的氢气的体积,收集氢气后滴定管内液面读数减小,故测定氢气的体积为:V1-V2,故答案为:V1-V2。

 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案【题目】铁在化合物中通常是Fe(Ⅱ)、Fe(Ⅲ),现有一定量固体物质A,可能由FeSO4、Fe2(SO4)3组成,通过实验确定其成分。探究过程如下:
(1)提出假设:(请把下列假设补充完整)
假设:该固体物质是FeSO4;或该固体物质是Fe2(SO4)3;或该固体物质是___。
(2)设计实验方案:取少量固体物质A于烧杯中,加适量水溶解A,然后取两份A溶液分别进行实验,实验现象与结论如表:
实验方法 | 实验现象 | 结论 |
在溶液中加入KSCN溶液 | ___ | 固体物质中有Fe2(SO4)3 |
在酸性KMnO4溶液中加入少量A振荡 | KMnO4溶液颜色无明显变化 | 固体物质中不含___。 |
(3)若该固体A可能还存在铁,则不能证明固体物质中含___,其理由至少有两个,请分别用离子方程式表示___、___。
(4)![]() ,写出由“白色沉淀”转化为“红褐色沉淀”的化学方程式___。
,写出由“白色沉淀”转化为“红褐色沉淀”的化学方程式___。
(5)上述白色沉淀在空气中迅速变成灰绿色,最后变成红褐色,由此得出Fe(Ⅱ)的还原性强弱与___有关,FeSO4的还原性___Fe(OH)2(填“大于”“小于”或“等于”)。
【题目】将足量X气体通入Y溶液中,实验结果与预测现象一致的组合是( )
X气体 | Y溶液 | 预测现象 |
| |
① | CO2 | Na2SiO3溶液 | 有白色沉淀产生 | |
② | SO2 | BaCl2溶液 | 有白色沉淀产生 | |
③ | Cl2 | AgNO3溶液 | 有白色沉淀产生 | |
④ | NH3 | AlCl3溶液 | 有白色沉淀产生 |
A.只有①②③B.只有①②④
C.只有①③④D.①②③④
【题目】(1)元素周期表是我们研究物质性质、结构的重要工具,对周期表的熟悉和掌握程度直接影响我们对化学的学习。元素周期表共有七个周期十六个族;第ⅠA族元素(除氢外)的最高价氧化物对应水化物都是易溶于水的强碱,又称为___元素,卤族元素位于第__纵行,最高正价与最低负价的绝对值相等的元素位于___族。
(2)A、B、C、D、E、F、G为原子序数依次增大的前20号元素(此时不考虑稀有气体元素),在周期表中B和C,C和E分别相邻,B、E、G的最外层电子数之和为12。已知部分元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
A | 该元素有一种核素质量数为1 |
B | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
D | 原子的次外层电子数是最外层电子数的两倍 |
①由元素A、B形成的核外电子总数为10e-的两种微粒:___,___(写化学式)。
②C元素在周期中的位置:___。
③C、D形成的化合物在通讯上的重要用途___。
④E与G两元素可形成化合物,用电子式表示其化合物的形成过程:___。
⑤用化学方程式表示B、D两种元素的非金属性强弱___。
⑥A、B、F三种元素形成的一种常见化合物易溶于水,受热易分解,可用于制作干电池,该物质的电子式是___。