题目内容
【题目】某实验小组探究过量甲醛与新制氢氧化铜的反应,探究过程如下:
(一)提出猜想
(1)甲同学通过查阅资料,提出猜想1和猜想2。
猜想1:HCHO + Cu(OH)2![]() Cu + CO↑+ 2H2O
Cu + CO↑+ 2H2O
猜想2:HCHO + 4Cu(OH)2 + 2NaOH![]() 2Cu2O + Na2CO3 + 6H2O
2Cu2O + Na2CO3 + 6H2O
猜想1和猜想2均体现了甲醛的________性。
(2)乙同学类比乙醛与新制氢氧化铜的反应,提出猜想3。
用化学方程式表示猜想3:________。
(二)进行实验,收集证据
已知:可用银氨溶液检测CO,反应为CO + 2Ag(NH3)2OH ![]() 2Ag↓+ (NH4)2CO3 + 2NH3。实验在如下装置中进行。反应结束后,A中生成紫红色固体沉淀物,C中银氨溶液无明显变化,气囊略鼓起。
2Ag↓+ (NH4)2CO3 + 2NH3。实验在如下装置中进行。反应结束后,A中生成紫红色固体沉淀物,C中银氨溶液无明显变化,气囊略鼓起。
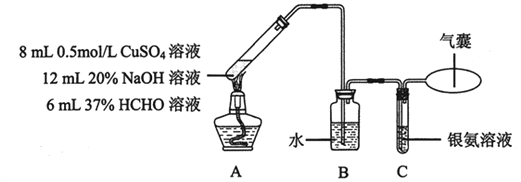
(3)配制银氨溶液所需的试剂是________。
(4)装置B中水的作用是________。
(5)甲同学取A中反应后溶液加入到足量稀盐酸中,无明显现象。乙同学另取该溶液加入到BaCl2溶液中,产生大量白色沉淀。
实验方案明显不合理的是________(填“甲”或“乙”),理由是________。
(6)已知Cu2O![]() Cu + CuSO4。
Cu + CuSO4。
丙同学通过实验证明生成的紫红色固体沉淀物是Cu,其实验方案为________。
(三)得出结论
(7)写出过量甲醛与新制氢氧化铜可能发生反应的化学方程式________。
【答案】 还原 HCHO + 2Cu(OH)2 + NaOH ![]() Cu2O↓ + HCOONa + 3H2O 硝酸银溶液和稀氨水 除去挥发的甲醛,防止干扰CO的检验 乙 该步骤的目的是检验反应后溶液中是否存在CO
Cu2O↓ + HCOONa + 3H2O 硝酸银溶液和稀氨水 除去挥发的甲醛,防止干扰CO的检验 乙 该步骤的目的是检验反应后溶液中是否存在CO![]() ,因溶液中含有SO
,因溶液中含有SO![]() ,如直接加入到BaCl2溶液中,SO
,如直接加入到BaCl2溶液中,SO![]() 遇Ba2+会生成白色沉淀BaSO4,干扰CO
遇Ba2+会生成白色沉淀BaSO4,干扰CO![]() 的检验 取生成的紫红色固体置于试管中,加入适量稀硫酸,充分振荡,无明显现象 HCHO + Cu(OH)2 + NaOH
的检验 取生成的紫红色固体置于试管中,加入适量稀硫酸,充分振荡,无明显现象 HCHO + Cu(OH)2 + NaOH![]() Cu↓ + HCOONa + 2H2O
Cu↓ + HCOONa + 2H2O
【解析】一、(1)猜想1和猜想2中甲醛中的碳分别升高为+2价和+4价,均体现了甲醛的还原性。(2)乙同学类比乙醛与新制氢氧化铜的反应,有砖红色的固体析出,用化学方程式表示猜想3:HCHO + 2Cu(OH)2 + NaOH ![]() Cu2O↓ + HCOONa + 3H2O;(3)配制银氨溶液所需的试剂是硝酸银溶液和稀氨水;(4)装置B中水的作用是:除去挥发的甲醛,防止干扰CO的检验;(5)乙 (6). 该步骤的目的是检验反应后溶液中是否存在CO32-,如直接加入到BaCl2溶液中,SO42-遇Ba2+会生成白色沉淀BaSO4,干扰CO32-的检验;(6)氧化亚铜在酸性条件下,会溶解生成硫酸铜,溶液呈蓝色,所以检验方法为:取生成的紫红色固体置于试管中,加入适量稀硫酸,充分振荡,无明显现象;(7)HCHO + Cu(OH)2 + NaOH
Cu2O↓ + HCOONa + 3H2O;(3)配制银氨溶液所需的试剂是硝酸银溶液和稀氨水;(4)装置B中水的作用是:除去挥发的甲醛,防止干扰CO的检验;(5)乙 (6). 该步骤的目的是检验反应后溶液中是否存在CO32-,如直接加入到BaCl2溶液中,SO42-遇Ba2+会生成白色沉淀BaSO4,干扰CO32-的检验;(6)氧化亚铜在酸性条件下,会溶解生成硫酸铜,溶液呈蓝色,所以检验方法为:取生成的紫红色固体置于试管中,加入适量稀硫酸,充分振荡,无明显现象;(7)HCHO + Cu(OH)2 + NaOH![]() Cu↓ + HCOONa + 2H2O。
Cu↓ + HCOONa + 2H2O。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如表:下列说法正确的是( )
2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如表:下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 该温度下此反应的平衡常数K=1.44
B. 其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正)
C. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
D. 0~2min的平均速率ν(Z)=2.0×10﹣3molL﹣1min﹣1