题目内容
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,吸附气体的能力强,性质稳定。请回答下列问题:
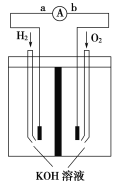
(1)负极反应为____________________________________。
(2)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一,金属锂是一种重要的储氢材料,吸氢和放氢原理如下:Ⅰ.2Li+H2![]() 2LiH,Ⅱ.LiH+H2O=LiOH+H2↑,反应Ⅰ中的还原剂是________,反应Ⅱ中的氧化剂是________。
2LiH,Ⅱ.LiH+H2O=LiOH+H2↑,反应Ⅰ中的还原剂是________,反应Ⅱ中的氧化剂是________。
【答案】2H2+4OH--4e-=4H2O或H2+2OH--2e-=2H2O Li H2O
【解析】
(1)原电池的负极发生失去电子的氧化反应;
(2)失去电子的物质是还原剂,得到电子的物质是氧化剂,结合元素化合价分析判断。
(1)氢气在反应中失去电子,氢气在负极通入,由于电解质溶液显碱性,则负极反应为H2+2OH--2e-=2H2O。
(2)反应Ⅰ中Li元素化合价从0价升高到+1价,失去电子,Li是还原剂;反应Ⅱ的水中氢元素化合价从+1价降低到0价得到电子,LiH中氢元素化合价从-1价升高到0价,失去电子,所以氧化剂是H2O。

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目