题目内容
【题目】工业上用蚀刻液浸泡铜板可制备印刷电路板,产生的蚀刻废液需要回收利用。
(1)应用传统蚀刻液(HCl-FeCl3)
①蚀刻铜板主要反应的离子方程式为________。
②该蚀刻液中加入一定量盐酸的目的为________,同时提高蚀刻速率。
③FeCl3型酸性废液处理是利用Fe和Cl2分别作为还原剂和氧化剂,可回收铜并使蚀刻液再生。发生的主要化学反应有:Fe+2Fe3+ ![]() 3Fe2+、Fe+Cu2+
3Fe2+、Fe+Cu2+ ![]() Fe2++Cu,还有________、________。(用离子方程式表示)。
Fe2++Cu,还有________、________。(用离子方程式表示)。
(2)应用酸性蚀刻液(HCl-H2O2),产生的蚀刻废液处理方法如下:
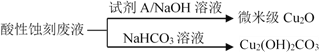
①蚀刻铜板主要反应的离子方程式为________。
②回收微米级Cu2O过程中,加入的试剂A是______(填字母)。
a.Fe粉 b.葡萄糖 c. NaCl固体 d.酸性KMnO4溶液
③回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是________。
(3)应用碱性蚀刻液(NH3H2O–NH4Cl) 蚀刻铜板,会有Cu(NH3)4Cl2和水生成。蚀刻铜板主要反应的化学方程式为________。
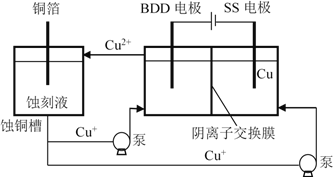
(4)与常规方法不同,有研究者用HCl-CuCl2做蚀刻液。蚀铜结束,会产生大量含Cu+废液,采用如图所示方法,可达到蚀刻液再生、回收金属铜的目的。此法采用掺硼的人造钻石BDD电极,可直接从水中形成一种具有强氧化性的氢氧自由基(HO),进一步反应实现蚀刻液再生,结合化学用语解释CuCl2蚀刻液再生的原理________。
【答案】 2 Fe3++ Cu ![]() 2Fe2+ +Cu2+ 抑制FeCl3水解 Fe+2H+
2Fe2+ +Cu2+ 抑制FeCl3水解 Fe+2H+ ![]() Fe2++H2↑ 2Fe2+ + Cl2
Fe2++H2↑ 2Fe2+ + Cl2 ![]() 2Fe3++ 2Cl- Cu + 2H+ + H2O2
2Fe3++ 2Cl- Cu + 2H+ + H2O2 ![]() Cu2+ + 2H2O b 温度高于80℃时,Cu2(OH)2CO3易分解生成黑色CuO,导致产品颜色发暗 2Cu + 4NH4Cl + 4NH3H2O + O2
Cu2+ + 2H2O b 温度高于80℃时,Cu2(OH)2CO3易分解生成黑色CuO,导致产品颜色发暗 2Cu + 4NH4Cl + 4NH3H2O + O2 ![]() 2Cu(NH3)4Cl2 + 6H2O 在阳极发生反应H2O – e–
2Cu(NH3)4Cl2 + 6H2O 在阳极发生反应H2O – e– ![]() HO + H+ ,H+ + Cu+ + OH
HO + H+ ,H+ + Cu+ + OH ![]() Cu2+ + H2O生成Cu2+,Cl-通过阴离子交换膜移入阳极区, CuCl2蚀刻液再生
Cu2+ + H2O生成Cu2+,Cl-通过阴离子交换膜移入阳极区, CuCl2蚀刻液再生
【解析】(1)应用传统蚀刻液(HCl-FeCl3),①Fe3+具有氧化性,蚀刻铜板主要反应铁离子将铜氧化,离子方程式为2 Fe3++ Cu ![]() 2Fe2+ +Cu2+。②该蚀刻液中加入一定量盐酸的目的为抑制FeCl3水解,同时提高蚀刻速率。③FeCl3型酸性废液处理是利用Fe和Cl2分别作为还原剂和氧化剂,可回收铜并使蚀刻液再生。发生的主要化学反应有:Fe+2Fe3+
2Fe2+ +Cu2+。②该蚀刻液中加入一定量盐酸的目的为抑制FeCl3水解,同时提高蚀刻速率。③FeCl3型酸性废液处理是利用Fe和Cl2分别作为还原剂和氧化剂,可回收铜并使蚀刻液再生。发生的主要化学反应有:Fe+2Fe3+ ![]() 3Fe2+、Fe+Cu2+
3Fe2+、Fe+Cu2+ ![]() Fe2++Cu,还有Fe+2H+ = Fe2++H2↑和 2Fe2+ + Cl2 = 2Fe3++ 2Cl-。(2)①H2O2在酸性条件下具有强氧化性,可氧化Cu生成CuCl2,蚀刻铜板主要反应的离子方程式为Cu + 2H+ + H2O2
Fe2++Cu,还有Fe+2H+ = Fe2++H2↑和 2Fe2+ + Cl2 = 2Fe3++ 2Cl-。(2)①H2O2在酸性条件下具有强氧化性,可氧化Cu生成CuCl2,蚀刻铜板主要反应的离子方程式为Cu + 2H+ + H2O2 ![]() Cu2+ + 2H2O。②HCl-H2O2型蚀刻液含有Cu2+,在碱性条件下生成Cu(OH)2,可与弱还原剂生成Cu2O,选项中葡萄糖资源广,无害,最合适,回收微米级Cu2O过程中,加入的试剂A是b.葡萄糖。③回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是:温度高于80℃时,Cu2(OH)2CO3易分解生成黑色CuO,导致产品颜色发暗。(3)应用碱性蚀刻液(NH3H2O–NH4Cl) 蚀刻铜板,会有Cu(NH3)4Cl2和水生成。Cu2+易与NH3发生反应生成配合物Cu(NH3)4Cl2,蚀刻铜板主要反应的化学方程式为 2Cu + 4NH4Cl + 4NH3H2O + O2
Cu2+ + 2H2O。②HCl-H2O2型蚀刻液含有Cu2+,在碱性条件下生成Cu(OH)2,可与弱还原剂生成Cu2O,选项中葡萄糖资源广,无害,最合适,回收微米级Cu2O过程中,加入的试剂A是b.葡萄糖。③回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是:温度高于80℃时,Cu2(OH)2CO3易分解生成黑色CuO,导致产品颜色发暗。(3)应用碱性蚀刻液(NH3H2O–NH4Cl) 蚀刻铜板,会有Cu(NH3)4Cl2和水生成。Cu2+易与NH3发生反应生成配合物Cu(NH3)4Cl2,蚀刻铜板主要反应的化学方程式为 2Cu + 4NH4Cl + 4NH3H2O + O2 ![]() 2CuNH3)4Cl2 + 6H2O。(4)在阳极发生反应H2O – e–
2CuNH3)4Cl2 + 6H2O。(4)在阳极发生反应H2O – e– ![]() HO + H+ ,H+ + Cu+ + OH
HO + H+ ,H+ + Cu+ + OH ![]() Cu2+ + H2O生成Cu2+,Cl-通过阴离子交换膜移入阳极区, CuCl2蚀刻液再生。
Cu2+ + H2O生成Cu2+,Cl-通过阴离子交换膜移入阳极区, CuCl2蚀刻液再生。