题目内容
【题目】工业废弃铬渣对人体以及环境危害极大,铬渣含有Na2SO4及少量Cr2O72-、Fe3+;某工厂从铬渣中提取硫酸钠的工艺如图1:
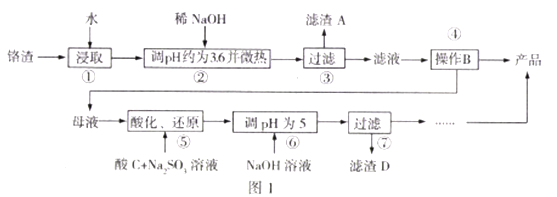
己知:I.Fe3+、Cr3+完全沉淀(c≦1.0×10-5mol/L)时pH分别为3.6和5;
Ⅱ.Cr2O72-还原产物为Cr3+。
(1)步骤2调节pH=3.6的目的为______,“微热”的作用为_______。
(2)Na2SO4和Na2Cr2O7的溶解度随温度变化曲线如图2,操作B的方法为_________.
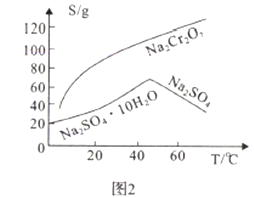
A.蒸发结晶、趁热过滤 B.蒸发浓缩,降温结晶,过滤
(3)步骤5中酸C不能选择硝酸的理由为____________,酸化、还原过程发生反应的离子方程式为_______,若将该反应设计为原电池(惰性电极),则负极的电极反应式为_______。
(4)Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=_______
(5)为了测定步骤3的滤液中Na2Cr2O7的浓度,进行步骤如下:
I.取100mL滤液;
Ⅱ.用cmol/L的标准KMnO4酸性溶液滴定bmL一定浓度的FeSO4溶液,消耗KMnO4溶液bmL;
Ⅲ.取bmL滤液,用上述FeSO4溶液滴定,达到滴定终点时,消耗dmLFeSO4溶液;则步骤3的滤液中Na2Cr2O7的含量为_________mol/L。
【答案】 沉淀Fe3+ 加快反应速率、促进Fe3+水解生成Fe(OH)3而除去 A 硝酸有氧化性且会引入新的杂质 3SO32- +Cr2O72-+8H+=2Cr3++3SO42-+4H2O SO32--2e-+H2O= SO42-+2H+ 1.0×10-32 5cd/6b
【解析】(1)步骤②的目的是沉淀Fe3+,Fe3+完全沉淀时的pH=3.6,所以调节pH=3.6的目的为沉淀Fe3+;加热能加快反应速率,使Fe3+沉淀速率更快,同时因为水解反应吸热,“微热”还可以促进Fe3+水解生成Fe(OH)3而除去;(2)根据图2溶解度与温度曲线,操作B的最佳方法为先将混合溶液蒸发浓缩,趁热过滤,趁热过滤的目的是有利于硫酸钠结晶析出,可以防止Na2Cr2O7析出,故答案选A;(3)硝酸有氧化性,会氧化Na2SO3,且会引入杂质NO3-,为保证最后得到纯净的硫酸钠,酸C为硫酸,不能选用硝酸等其他酸溶液。酸化后Cr2O72-可被SO32-还原成Cr3+,SO32-变为SO42-,离子方程式为:3SO32- +Cr2O72-+8H+=2Cr3++3SO42-+4H2O;根据该反应可知,SO32-在反应中失去电子,所以负极电极反应为:SO32--2e-+H2O= SO42-+2H+;(4)恰好完全沉淀时离子浓度c=1.0×10-5mol/L, Cr3+完全沉淀时pH=5,c(OH-)=1.0×10-9mol/L,所以Cr(OH)3的溶度积常数Ksp[Cr(OH)3]= 1.0×10-5mol/L×(1.0×10-9mol/L)3=1.0×10-32;(5)根据MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,可得c(FeSO4)=5cmol/L,根据Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O可得bmL滤液中含有Na2Cr2O7物质的量=![]() ×10-3mol,则c(Na2Cr2O7)=
×10-3mol,则c(Na2Cr2O7)= 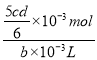 =
=![]() mol/L。
mol/L。

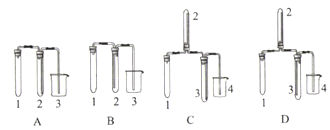
【题目】利用图示装置进行下列实验,能达到实验目的的是
溶液a | 固体b | 溶液c | 实验目的:验证 |
| |
A | 浓硝酸 | NaHCO3 | Na2SiO3 | 非金属性:N>C>Si | |
B | 浓盐酸 | KMnO4 | Na2S | 氧化性:KMnO4>Cl2>S | |
C | 浓盐酸 | CaCO3 | NaAlO2 | 酸性:HCl>H2CO3>Al(OH)3 | |
D | 浓氨水 | CaO | 酚酞溶液 | NH3·H2O是弱碱 |
A. A B. B C. C D. D