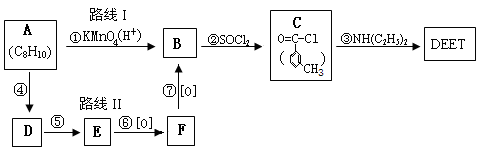
题目内容
(1)4.5gA中所含碳原子、氢原子的物质的量各为多少?
(2)通过计算确定有机物A的分子式.
| 5.4g |
| 18g/mol |
碱石灰增重6.6g为二氧化碳的质量,n(CO2)=
| 6.6g |
| 44g/mol |
6.72L氧气的物质的量=
| 6.72L |
| 22.4L/mol |
故CO的质量=4.5g+9.6g-5.4g-6.6g=2.1g,故n(CO)=
| 2.1g |
| 28g/mol |
故4.5gA中n(H)=2n(H2O)=0.6mol,n(C)=n(CO2)+n(CO)=0.15mol+0.075mol=0.225mol,
答:4.5gA中所含碳原子、氢原子的物质的量各是0.225mol、0.6mol.
(2)4.5gA中,n(H)=0.6mol,n(C)=0.225mol,
n(O)=2n(CO2)+n(CO)+n(H2O)-2n(O2)=2×0.15mol+0.075mol+0.3mol-2×0.3mol=0.075mol,
所以,n(C):n(H):n(O)=0.225mol:0.6mol:0.075mol=3:8:1,
A的最简式为C3H8O,3个碳原子所能结合的氢原子已达饱和,故A的分子式为C3H8O,
答:A的分子式为C3H8O.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(16分)最近全国各地持续出现雾霾天气,其首要污染物是可吸入颗粒物PM2.5和氮、硫的氧化物(PM2.5直径接近2.5×10-6m,1纳米=10-9m),主要来源为工业废气、机动车尾气等。因此对PM2.5 、SO2、NOx进行研究、处理意义重大。
(1) 下列关于PM2.5说法正确的是
a.PM2.5在空气中形成了胶体;
b.PM2.5表面积大,能吸附大量有毒、有害物质;
c.少开私家车,尽量选择公交、地铁出行,某种程度可以减少PM2.5污染
(2) 取PM2.5样本用蒸馏水处理制得试样,若测得该试样所含水溶性无机离子及其平均
浓度如下表
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度/ mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中的数据判断该试样的酸碱性为 ,其pH= 。
(3)对汽车尾气中的NOx进行研究
①NOx能形成酸雨,写出NO2转化为HNO3的化学方程式 。
②汽车尾气系统中装有催化转化器,可将NOx还原成N2排出,已知下列热化学方程式:
ⅰ N2(g) +O2(g)  2NO(g) △H=+180.5kJ·mol-1
2NO(g) △H=+180.5kJ·mol-1
ⅱ 2C(s)+ O2(g) 2CO(g) △H =- 221.0 kJ·mol-1
2CO(g) △H =- 221.0 kJ·mol-1
ⅲ C(s)+ O2(g) CO2( g) △H =- 393.5 kJ·mol-1
CO2( g) △H =- 393.5 kJ·mol-1
温度升高,反应ⅲ化学平衡常数 。(填“增大”或“减小”或“不变”)
写出NO(g)和CO(g) 反应生成N2(g) CO2(g)的热化学方程式 。
(4)将工厂废气中产生的SO2通过下列流程,可以转化为有应用价值的硫酸钙等
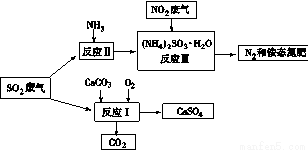
①写出反应Ⅰ的化学方程式: 。
②生产中,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是 。
③检验经过反应Ⅲ得到的氨态氮肥中SO42-所用试剂是 。

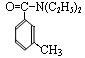
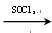 RCOCl(酰氯);RCOCl + NH3→RCONH2 + HCl,
RCOCl(酰氯);RCOCl + NH3→RCONH2 + HCl,