题目内容
(16分)最近全国各地持续出现雾霾天气,其首要污染物是可吸入颗粒物PM2.5和氮、硫的氧化物(PM2.5直径接近2.5×10-6m,1纳米=10-9m),主要来源为工业废气、机动车尾气等。因此对PM2.5 、SO2、NOx进行研究、处理意义重大。
(1) 下列关于PM2.5说法正确的是
a.PM2.5在空气中形成了胶体;
b.PM2.5表面积大,能吸附大量有毒、有害物质;
c.少开私家车,尽量选择公交、地铁出行,某种程度可以减少PM2.5污染
(2) 取PM2.5样本用蒸馏水处理制得试样,若测得该试样所含水溶性无机离子及其平均
浓度如下表
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度/ mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中的数据判断该试样的酸碱性为 ,其pH= 。
(3)对汽车尾气中的NOx进行研究
①NOx能形成酸雨,写出NO2转化为HNO3的化学方程式 。
②汽车尾气系统中装有催化转化器,可将NOx还原成N2排出,已知下列热化学方程式:
ⅰ N2(g) +O2(g)  2NO(g) △H=+180.5kJ·mol-1
2NO(g) △H=+180.5kJ·mol-1
ⅱ 2C(s)+ O2(g) 2CO(g) △H =- 221.0 kJ·mol-1
2CO(g) △H =- 221.0 kJ·mol-1
ⅲ C(s)+ O2(g) CO2( g) △H =- 393.5 kJ·mol-1
CO2( g) △H =- 393.5 kJ·mol-1
温度升高,反应ⅲ化学平衡常数 。(填“增大”或“减小”或“不变”)
写出NO(g)和CO(g) 反应生成N2(g) CO2(g)的热化学方程式 。
(4)将工厂废气中产生的SO2通过下列流程,可以转化为有应用价值的硫酸钙等
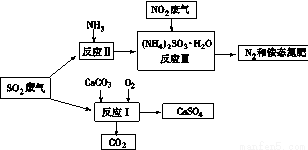
①写出反应Ⅰ的化学方程式: 。
②生产中,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是 。
③检验经过反应Ⅲ得到的氨态氮肥中SO42-所用试剂是 。
(16分)
(1)b、c (2分)
(2)酸性 4 (各1分,共2分)
(3) ① 3NO2 + H2O = 2HNO3 + NO (2分)
②减小 (2分)
2NO (g)+2 CO (g) =N2(g)+2CO2(g) △H =- 746.5kJ/mol (2分)
(4)① 2CaCO3 +O2 +2SO2= 2CaSO4 + 2CO2 (2分)
②防止亚硫酸铵(NH4) 2 SO3被氧化 (2分)
③盐酸和氯化钡(HCl 和 BaCl2) (2分)
【解析】
试题分析:(1)a、PM2.5是指微粒直径≤2.5×10-6米的微粒,而胶粒直径为1~100nm,即在10-9~10-7米之间,故在空气中不只形成了胶体,还有浊液,故a错误;b.PM2.5直径小,表面积大,能吸附大量有毒、有害物质,故b正确;c.少开私家车,尽量选择公交、地铁出行,某种程度可以减少PM2.5污染,故c正确,答案选bc;
(2)观察表格中发现NH4+水解显酸性,PM2.5的酸碱性为酸性.试样的pH值根据溶液中电荷守恒得c(K+)+c(Na+)+c(NH4+)+c(H+)=2c(SO42-)+c(NO3-)+c(Cl-)计算c(H+)= 10-4mol/L,pH值为4;
(3)①NO2转化为HNO3的化学方程式为:3NO2+H2O=2HNO3+NO;
②ⅰN2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1 ①
ⅱ2C(s)+O2(g)═2CO(g)△H=-221.0kJ?mol-1 ②
ⅲC(s)+O2(g)═CO2( g)△H=-393.5kJ?mol-1 ③
反应ⅲ正反应放热,温度升高平衡逆向移动,反应物浓度增大,生成物浓度减小,化学平衡常数减小;
由盖斯定律,NO(g)和CO(g)反应生成N2(g)、CO2(g)的热化学方程式可由③×2-①-②得到,即2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJ/mol;
(4)①根据反应物和生成物,写出反应Ⅰ的化学方程式为:2CaCO3+O2+2SO2=2CaSO4+2CO2;
②亚硫酸根离子易被空气中的氧气氧化,所以向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是防止亚硫酸铵(NH4)2SO3被氧化;
③检验SO42-所用试剂是盐酸和氯化钡(HCl和BaCl2)。
考点:考查常见的生活环境的污染及治理;反应热和焓变;热化学方程式;化学平衡常数的含义;二氧化硫的化学性质,硫酸根离子的检验

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案