��Ŀ����
����Ŀ��ʵ������������װ�ý���SO2���Ʊ�������ʵ��
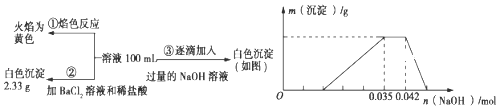
����֪ϡ���ᡢ��������Ϊ������ʱ��һ���仹ԭ����Ϊһ��������
��lg2=0.3
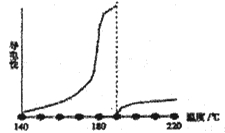
��SO2������ˮ��ͨ���������ܽ�������Ϊ1��40

�ش��������⣺
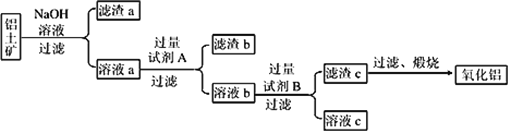
��1������ȡSO2��Ӧ�Ļ�ѧ����ʽΪ_____________________________________________��
��ʵ�鿪ʼʱ�����5g CaCO3��������_____________________________________��
��2���ٵ�__________________ʱ����NaHSO3���嶶����ƿ�У��۲쵽Dƿ��Eƿ���ִ���������
��д��Dƿ�з�����Ӧ�����ӷ���ʽ_____________________________________��
�ۣ�1������2��������ӦA�еĵ����ܿڵ�λ����_____________��
A.ǰ��a����b�� B.ǰ��a����a�� C.ǰ��b����b�� D.ǰ��b����a��
��3��ʵ������B���Գ�������C�����л��ǣ�ͨ���ֳּ������B��C��Һ��pH�仯�õ�����ͼ��
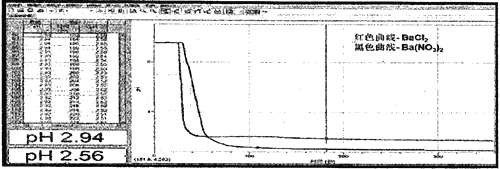
ͨ�����ۼ��㣬��C�����е�NO3-����ԭ��������Һ��ϡ10����pHΪ_______(��ȷС�����һλ)
��4�������������ʵ�鷽������SO2ͨ��BaCl2��Һ����ͨ��Ba(NO3)2��Һ��pH ����������NO3-�ܽ�SO2���������ۼ���ֵ��ʵ�ʲ��ֵ���ܴ�����ԭ����ͬ�����£�ϡHNO3��������_____ ϡ HNO2�������ԣ��ǿ�ڡ������ڡ��ӽ���������ʵ������ڰ�ȫ�������ȱ�ݣ����ڲ������Լ�ƿ��ǰ���¼��ԸĽ�_________________________��
���𰸡� NaHSO3+HC1= NaCl+SO2��+H2O ��ȡCO2����װ��ϵͳ�еĿ�������������е���������ʵ�� E�г��ְ�ɫ����ʱ SO2+2NO2-+Ba2+=BaSO4��+2NO C��D(ȫѡ��ѡһ��������) ��2NO3-+3SO2+2H2O+3Ba2+= 3BaSO4��+4H+ +2NO����õ���ҺpH= 0.7 ���� ��ÿ��ϴ��ƿ������װ�õ���ƿ��һ���ܣ�һ�˲�����Һ�У�һ����ͨ������ƽ����ѹ
�������������������1����NaHSO3��HC1��Ӧ�����Ȼ��ơ���������ˮ����CaCO3�����ᷴӦ���ɶ�����̼���壬����װ��ϵͳ�еĿ�������������е���������ʵ�飻��2����Ϊ��������е���������ʵ�飬��װ���г���������̼ʱ����NaHSO3���嶶����ƿ�У���Dƿ���ִ���������˵��D�ж�������������������ΪSO42-�������������ᱵ�������۵ڣ�1������Ӧ����ȡ�Ķ�����̼�ų�������������̼���ܶȴ��ڿ���������Ӧ��b���ų��������ڣ�2������Ӧ���Ʊ������������������������װ���У�����������ܶȴ��ڶ�����̼�����Դ�a�ڻ�b���ų���������3����������ͨ��C�з�Ӧ�����ӷ���ʽ��2NO3-+3SO2+2H2O+3Ba2+= 3BaSO4��+4H+ +2NO�����ݷ�Ӧ����ʽ����pH����4��ͬŨ�ȵ����ᱵ���Ȼ�����Һͨ���������C�����л��ǡ�Dƿ���ִ�����������ʵ���������������
��������1����NaHSO3��HC1��Ӧ�����Ȼ��ơ���������ˮ����Ӧ����ʽ��NaHSO3+HC1= NaCl+SO2��+H2O����CaCO3�����ᷴӦ���ɶ�����̼���壬����װ��ϵͳ�еĿ�������������е���������ʵ�飻��2����Ϊ��������е���������ʵ�飬��װ���г���������̼ʱ����NaHSO3���嶶����ƿ�У�װ���г���������̼ʱ��������E�г��ְ�ɫ��������Dƿ���ִ���������˵��D�ж�������������������ΪSO42-�������������ᱵ��������Ӧ���ӷ���ʽ��SO2+2NO2-+Ba2+=BaSO4��+2NO���۵ڣ�1������Ӧ����ȡ�Ķ�����̼�ų�������������̼���ܶȴ��ڿ���������Ӧ��b���ų��������ڣ�2������Ӧ���Ʊ������������������������װ���У�����������ܶȴ��ڶ�����̼�����Դ�a�ڻ�b���ų�������������Ӧ����ǰ��b����a����ǰ��b����b���� ��3����������ͨ��C�з�Ӧ�����ӷ���ʽ��2NO3-+3SO2+2H2O+3Ba2+= 3BaSO4��+4H+ +2NO��C��NO3-��Ũ����1mol/L�����ݷ�Ӧ����ʽ��C�����е�NO3-����ԭ����Һ��������Ũ����2 mol/L����Һ��ϡ10����������Ũ����0.2 mol/L,pH=![]() ����4��ͬŨ�ȵ����ᱵ���Ȼ�����Һͨ���������C�����л��ǡ�Dƿ���ִ���������˵��ϡHNO3������������ϡ HNO2�������ԣ���ʵ������������������ԸĽ���������ÿ��ϴ��ƿ������װ�õ���ƿ��һ���ܣ�һ�˲�����Һ�У�һ����ͨ������ƽ����ѹ��
����4��ͬŨ�ȵ����ᱵ���Ȼ�����Һͨ���������C�����л��ǡ�Dƿ���ִ���������˵��ϡHNO3������������ϡ HNO2�������ԣ���ʵ������������������ԸĽ���������ÿ��ϴ��ƿ������װ�õ���ƿ��һ���ܣ�һ�˲�����Һ�У�һ����ͨ������ƽ����ѹ��