题目内容
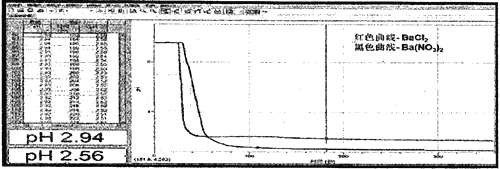
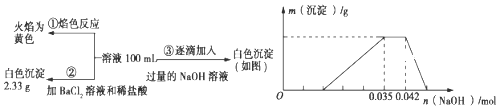
【题目】2017年3月21日是第二十五届“世界水日”,保护水资源,合理利用废水节省水资源,加强废水的回收利用已被越来越多的人所关注。已知:某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3﹣、CO32﹣、SO42﹣中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关图象如下所示:
请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的阴离子是_____,一定存在的阳离子是_____。
(2)写出实验③图象中沉淀达到最大量且质量不再发生变化阶段发生反应的离子反应方程式:_____。
(3)分析图象,在原溶液中c(NH4+)与c(Al3+)的比值为_____,所得沉淀的最大质量是_____g。
(4)若通过实验确定原废水中c(Na+)=0.14molL﹣1,试判断原废水中NO3﹣是否存在?_____(填“存在”“不存在”或“不确定”)。若存在,c(NO3﹣)=_____ molL﹣1。(若不存在或不确定则此空不填)
【答案】CO32﹣ Na+、H+、Al3+、NH4+ NH4++OH﹣=NH3H2O 1:1 0.546 存在 0.36
【解析】
无色废水确定无Fe3+,根据实验①确定有Na+,根据实验②确定有SO42-,根据实验③确定有H+、Al3+,一定不含Fe3+、Mg2+,因为CO32-与Al3+不能共存,所以无CO32-;故溶液中一定存在的离子为:Na+、Al3+、NH4+、H+、SO42-,结合电荷守恒判断有无硝酸根离子。
(1)无色废水确定无Fe3+,根据焰色反应显黄色确定有Na+;加入盐酸酸化的氯化钡溶液得到2.33g白色沉淀,白色沉淀是硫酸钡,一定有SO42-,逐滴加入过量的氢氧化钠溶液,开始没有沉淀产生,说明含有氢离子。沉淀达到最大值以后,继续加入氢氧化钠溶液,沉淀不变,说明还含有铵根离子。最终沉淀完全消失,说明含有铝离子,不存在镁离子。因为CO32-与Al3+不能共存,所以无CO32-,硝酸根离子无法判断,故废水中一定不存在的阴离子是CO32﹣,一定存在的阳离子是Na+、H+、Al3+、NH4+。
(2)实验③图象中沉淀达到最大量且质量不再发生变化阶段发生的反应是铵根与氢氧根反应,反应的离子反应方程式为NH4++OH﹣=NH3H2O。
(3)已知硫酸钡沉淀为2.33g,则n(SO42-)=2.33g÷233g/mol=0.01mol,根据图象可知与Al(OH)3反应的OH-为:n(OH-)=0.007mol,根据Al(OH)3+OH-=AlO2-+2H2O可知n(Al3+)=0.007mol,将铝离子沉淀需要氢氧化钠0.021mol,所以溶液中H+消耗氢氧化钠0.014mol,氢离子的物质的量是0.014mol,根据NH4++OH-=NH3H2O可知消耗氢氧化钠0.007mol,所以铵根离子的物质的量是0.007mol,则原溶液中c(NH4+)与c(Al3+)的比值为1:1;生成Al(OH)3的质量为0.007mol×78g/mol=0.546g;
(4)溶液中存在的离子为:Na+、Al3+、NH4+、H+、SO42-,已知n(SO42-)=0.01mol,n(Al3+)=0.007mol,n(H+)=0.014mol,n(NH4+)=0.007mol,溶液中存在电荷守恒,3n(Al3+)+n(H+)+n(NH4+)+n(Na+)=3×0.007mol+0.014mol+0.007mol+0.14mol·L-1×0.1L=0.056mol≠2n(SO42-)=0.02mol,则一定含有NO3-,且n(NO3-)=0.056mol-0.02mol=0.036mol,c(NO3-)=0.036mol÷0.1L=0.36mol/L。