题目内容
【题目】若往10mL 0.1mol/L甲酸(HCOOH)溶液中逐滴加入一定浓度的烧碱溶液,测得溶液的温度变化如图所示.下列说法正确的是
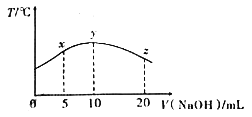
A. 该烧碱溶液的物质的量浓度为0.01mol/L
B. x点溶液中存在:2c(Na+)=c(HCOO-)+c(HCOOH)
C. y点时,甲酸的电离平衡常数最大,且溶液呈中性
D. 从y点到z点,混合溶液中一直存在:c(Na+)>c(HCOO-)>c(OH-)>c(H+)
【答案】B
【解析】A、酸碱中和反应是放热反应,当恰好完全中和时放出热量最多,c(NaOH)=0.010L×0.01mol/L/0.010L=0.01mol/L,A错误,②正确;B. x点溶液中溶质是甲酸钠甲酸的混合溶液,且二者的浓度相等,根据物料守恒可知存在:2c(Na+)=c(HCOO-)+c(HCOOH),B正确;C、y点时二者恰好反应,温度最高,甲酸的电离平衡常数最大,甲酸根水解,溶液呈碱性,C错误;D、从y点到z点,当c(NaOH)较大时,可能出现:c(Na+)>c(OH-)>c(HCOO-)>c(H+),D错误;答案选B。

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案
相关题目

