题目内容
1.工业上制备BaCl2的工艺流程图如下: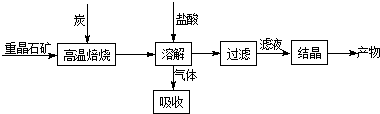
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验.查表得:
BaSO4(s)+4C(s)$\frac{\underline{\;高温\;}}{\;}$4CO(g)+BaS(s)△H1=+571.2kJ•mol-1 ①
BaSO4(s)+2C(s)$\frac{\underline{\;高温\;}}{\;}$2CO2(g)+BaS(s)△H2=+226.2kJ•mol-1 ②
(1)气体用过量NaOH溶液吸收,得到Na2S.Na2S水解的离子方程式为S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-.
(2)根据已知的反应①②写出炭还原CO2的热化学反应方程式C(s)+CO2(g)$\frac{\underline{\;高温\;}}{\;}$2CO(g)△H=+172.5kJ•mol-1.
(3)盐酸能溶解 BaS固体的原因是加入稀盐酸后,S2-+2H+=H2S↑,破坏了BaS的溶解平衡,使溶解平衡向正方向移动.
分析 (1)Na2S对应的为二元弱酸氢硫酸,硫离子水解分步完成,以第一步水解为主;
(2)由BaSO4(s)+4C(s)$\frac{\underline{\;高温\;}}{\;}$4CO(g)+BaS(s)△H1=+571.2kJ•mol-1 ①
BaSO4(s)+2C(s)$\frac{\underline{\;高温\;}}{\;}$2CO2(g)+BaS(s)△H2=+226.2kJ•mol-1 ②
结合盖斯定律可知,(①-②)×$\frac{1}{2}$得到C(s)+CO2(g)$\frac{\underline{\;高温\;}}{\;}$2CO(g);
(3)盐酸可促进BaS的溶解平衡正向移动.
解答 解:(1)Na2S水解的离子方程式为S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-,故答案为:S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-;
(2)由BaSO4(s)+4C(s)$\frac{\underline{\;高温\;}}{\;}$4CO(g)+BaS(s)△H1=+571.2kJ•mol-1 ①
BaSO4(s)+2C(s)$\frac{\underline{\;高温\;}}{\;}$2CO2(g)+BaS(s)△H2=+226.2kJ•mol-1 ②
结合盖斯定律可知,(①-②)×$\frac{1}{2}$得到C(s)+CO2(g)$\frac{\underline{\;高温\;}}{\;}$2CO(g),
△H=(+571.2kJ•mol-1-226.2kJ•mol-1)×$\frac{1}{2}$=+172.5kJ•mol-1,
即热化学方程式为C(s)+CO2(g)$\frac{\underline{\;高温\;}}{\;}$2CO(g)△H=+172.5kJ•mol-1,
故答案为:C(s)+CO2(g)$\frac{\underline{\;高温\;}}{\;}$2CO(g)△H=+172.5kJ•mol-1;
(3)BaS(S)?Ba2+(aq)+S2- (aq),加入稀盐酸后,S2-+2H+=H2S↑,破坏了BaS的溶解平衡,使溶解平衡向正方向移动,故BaS能溶于稀盐酸,
故答案为:加入稀盐酸后,S2-+2H+=H2S↑,破坏了BaS的溶解平衡,使溶解平衡向正方向移动.
点评 本题考查较综合,涉及盐类水解、盖斯定律计算反应热、溶解平衡移动等,注重高频考点的考查,把握相关反应原理为解答的关键,侧重分析与应用能力的考查,题目难度不大.

| A. | 用瓷坩埚高温熔融NaOH | |
| B. | 用氨气做喷泉实验主要是利用氨气的水溶液呈碱性这一性质 | |
| C. | 碳酸钠的溶解性比碳酸氢钠大 | |
| D. | 检验Fe2+用KSCN溶液 |
| 选项 | 化学反应及离子方程式 | 评价 |
| A | NaClO溶液中通往少量的SO2: ClO-+H2O+SO2=Cl-+SO42-+2H+ | 错误,碱性介质中不可能生成H+ |
| B | 用酸性高锰酸钾溶液滴定草酸: 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O | 正确 |
| C | NH4Al(SO4)2溶液中滴入少量NaOH溶液 NH4++OH-=NH3•H2O | 错误,OH-首先和Al3+反应生成Al(OH)3沉淀 |
| D | 用惰性电极电解CuCl2溶液 2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | 正确 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
| A. | 常温常压下,20 g重甲基(-14CD3)所含的中子数为11NA | |
| B. | 常温常压下,22.4 L NO气体的分子数小于NA | |
| C. | 64 g铜发生氧化还原反应,一定失去2NA个电子 | |
| D. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
| A. | 同一种元素各核素的质量数不同,但它们的化学性质几乎完全相同 | |
| B. | 任何元素的原子都是由核外电子和核内质子、中子组成 | |
| C. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H互称为核素 | |
| D. | ${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca、${\;}_{18}^{40}$Ar的质量数相同,所以它们是同位素 |
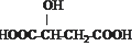
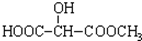 B.
B.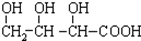 C.H3COOC-COOCH3
C.H3COOC-COOCH3 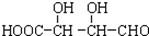 E.
E.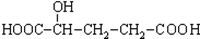
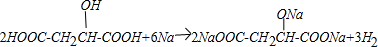 .
.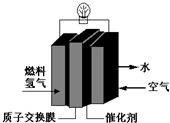 第29届奥运会期间,作为马拉松领跑车和电视拍摄车的汽车,装着“绿色心脏”--质子交换膜燃料电池,其工作原理如图所示.
第29届奥运会期间,作为马拉松领跑车和电视拍摄车的汽车,装着“绿色心脏”--质子交换膜燃料电池,其工作原理如图所示.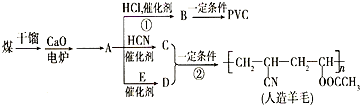 近年来,由于石油价格不断上涨,以煤为原料制备一些化工产品的前景又被看好.如图是以煤为原料生产(PVC)和人造羊毛的合成路线.
近年来,由于石油价格不断上涨,以煤为原料制备一些化工产品的前景又被看好.如图是以煤为原料生产(PVC)和人造羊毛的合成路线.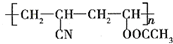 .
.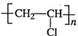 .
.