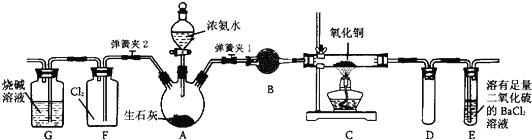
��Ŀ����
����Ŀ����һ���ܱ������н������·�Ӧ��2X2��g����Y2��g�� ![]() 2Z��g������Ӧ������ijһʱ��X2��Y2��Z��Ũ�ȷֱ�Ϊ0.2 mol��L��1��0.1 mol��L��1��0.2 mol��L��1������Ӧ�ﵽƽ��ʱ���������ݿ��ܺ��������� ��
2Z��g������Ӧ������ijһʱ��X2��Y2��Z��Ũ�ȷֱ�Ϊ0.2 mol��L��1��0.1 mol��L��1��0.2 mol��L��1������Ӧ�ﵽƽ��ʱ���������ݿ��ܺ��������� ��
A��Z��Ũ��Ϊ0.4 mol��L��1 B��X2��Z��Ũ�Ⱦ�Ϊ0.15 mol��L��1
C��X2��Ũ��Ϊ0.4 mol��L��1 D��X2��Z��Ũ��֮��Ϊ0.4 mol��L��1
���𰸡�D
��������
���������ijһʱ��X2��Y2��Z��Ũ�ȷֱ�Ϊ0.2molL-1��0.1molL-1��0.2molL-1��
2X2��g��+Y2��g��![]() 2Z��g����
2Z��g����
0.2 0.1 0.2
����ת�� 0 0 0.4
����ת�� 0.4 0.2 0
Zȫ��ת��ʱ��X2�����ʵ���Ũ��Ϊ��0.2mol/L+0.2mol/L=0.4L-1��Y2�����ʵ���Ũ��Ϊ��0.1mol/L+0.1mol/L=0.2molL-1����c��X2����ȡֵ��ΧΪ��0.2mol/L��c��X2����0.4 molL-1����X2ȫ��ת��ʱ��Z�����ʵ���Ũ��Ϊ��0.2mol/L+0.2mol/L=0.4molL-1��Y2�����ʵ���Ũ��Ϊ����c��Y2����ȡֵ��ΧΪ��0��c��Y2����0.2molL-1��c��Z����ȡֵ��ΧΪ��0.2mol/L��c��Z����0.4 molL-1��A��c��Z����ȡֵ��ΧΪ��0.2mol/L��c��Z����0.4 molL-1����A����B����X2��Z��Ũ�Ⱦ�Ϊ0.15 molL-1����Ӧ������У���Ӧ��X2Ũ��0.05mol/L������ZŨ��Ϊ0.05mol/L����Zƽ��Ũ�ȿ���Ϊ0.25mol/L����B����C��c��X2����ȡֵ��ΧΪ��0.2mol/L��c��X2����0.4 molL-1����C����D����X2��Z��Ũ��֮��Ϊ0.4 molL-1��X2Z��Ũ�ȷֱ�Ϊ0.2mol/L���������������У�����Ũ��֮�;�Ϊ0.4mol/L����D��ȷ����ѡD��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�