题目内容
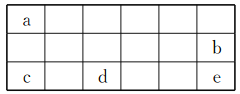
【题目】短周期元素X、Y、Z、W在周期表中的相对位置如图所示,其中W元素的原子结构示意图为![]() 。请回答下列问题:
。请回答下列问题:

(1)Z元素位于元素周期表中第_______周期_______族。
(2)X元素的最简单气态氢化物能与其最高价氧化物对应的水化物反应,得到的化合物属于________ (填“离子化合物”或“共价化合物”)。
(3)X、Y、Z三种元素的原子半径由大到小的顺序为________(用元素符号表示)。
(4)写出W单质与X的最高价氧化物对应水化物的浓溶液反应的化学方程式:________________。
【答案】 三 VA 离子化合物 P>N>O C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
【解析】W元素的原子结构示意图为![]() ,则b=2,即W的核电荷数为6,为碳元素,则X为N元素、Y为O元素、Z为P元素;
,则b=2,即W的核电荷数为6,为碳元素,则X为N元素、Y为O元素、Z为P元素;
(1)P元素核电荷数为15,位于元素周期表中第三周期VA族;
(2)N元素的最简单气态氢化物NH3能与其最高价氧化物对应的水化物HNO3反应生成NH4NO3,是一种铵盐,该化合物属于离子化合物;
(3)N、O为同周期主族元素,核电荷数大原子半径小,而N、P为同族元素,核电荷数大原子半径大,则三种元素的原子半径由大到小的顺序为 P>N>O;
(4)C与浓硫酸在加热条件下发生反应的化学方程式为C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O。
CO2↑+4NO2↑+2H2O。

 阅读快车系列答案
阅读快车系列答案【题目】通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。现给出化学键的键能(见下表):
化学键 | H—H | Cl—Cl | Cl—H |
键能/(kJ·mol-1) | 436 | 243 | 431 |
请计算H2(g)+Cl2(g)===2HCl(g)的反应热( )
A. +862 kJ·mol-1 B. +679 kJ·mol-1 C. -183 kJ·mol-1 D. +183 kJ·mol-1